カルパインによる生体機能維持の分子機構プロジェクト
〒156-8506 東京都世田谷区上北沢2-1-6 < English>
| |
| to Calpain Project Home |
| topics |
| members |
| introduction |
| research themes |
| publications |
| ぷろておりしす |
| The CALPAIN |
| links |
| access |
| to Igakuken top |
研究概要~専門家の方へ |
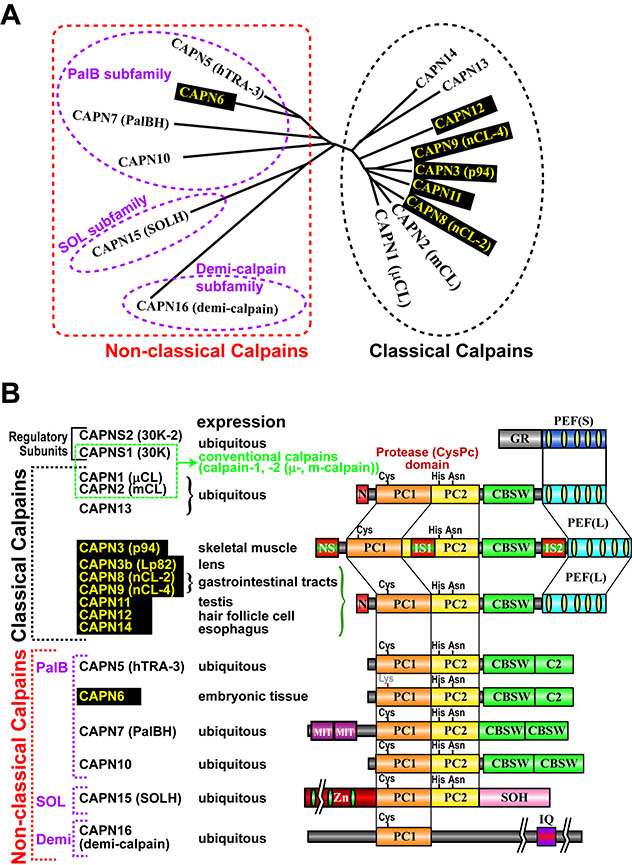
[一般の方はこちらへどうぞ] プロジェクトリーダーは1988年から、故 鈴木紘一先生率いる東京都臨床医学総合研究所・遺伝情報研究部門の研究員として、カルパインの研究を開始しました。その後素晴らしい研究仲間と出会うことができたため、彼らと共に2004年から再び東京都臨床医学総合研究所に戻り、酵素機能制御研究部門を立ち上げました。2005年よりプロジェクト制となり、第1期カルパイン・プロジェクトに、そして2010年より第2期カルパイン・プロジェクトとなっています。 カルパインはCa2+依存的に基質を限定的に切断(プロセシング)する細胞内プロテアーゼです。故 鈴木紘一先生率いる当時の遺伝情報部門は、カルパインの全構造を世界で最初に決定し、これがCa2+-シグナリングの一角を成すバイオ・モジュレータの一つであることを明らかとして、世界の注目を集めていました。従来から主に研究されていたのは、組織普遍的に存在するμ-及びm-カルパインであり、生命にとって基本的かつ必須な機能を担います。即ち、細胞内の基質に直接作用し、その機能・活性・構造を変換する細胞内モジュレータ・プロテアーゼと言えます。これまでに癌化、記憶、虚血障害、筋ジストロフィーなど様々な生命現象にカルパインの関与が報告されています。 私たちは1989年にμ-及びm-カルパイン活性サブユニット(CAPN1(カルパイン1と呼びます。μCLとも呼ばれました)及びCAPN2(mCL))に相同ですが、配列の異なる新規分子を発見しました。p94と命名したこの分子(後に、CAPN3と呼ばれるようになります)は、CAPN1やCAPN2とは異なり、骨格筋特異的発現を示しました。その後、胃腸特異的に発現するCAPN8(nCL-2)、及び、CAPN9(nCL-4)を同定しました。さらに、組織普遍的カルパインやカビ・酵母についても新規分子を同定し、カルパインがスーパーファミリー(図1)を形成することを明らかにすると共に、カルパイン研究を哺乳類から微生物にまで大きく拡大しました。組織特異的カルパインは、その発現組織の機能と関連が強く、生理現象により近い位置での機能解析が可能であるため、自ら見出したこれらの分子に焦点を当てて研究を続けて、現在に至っています。
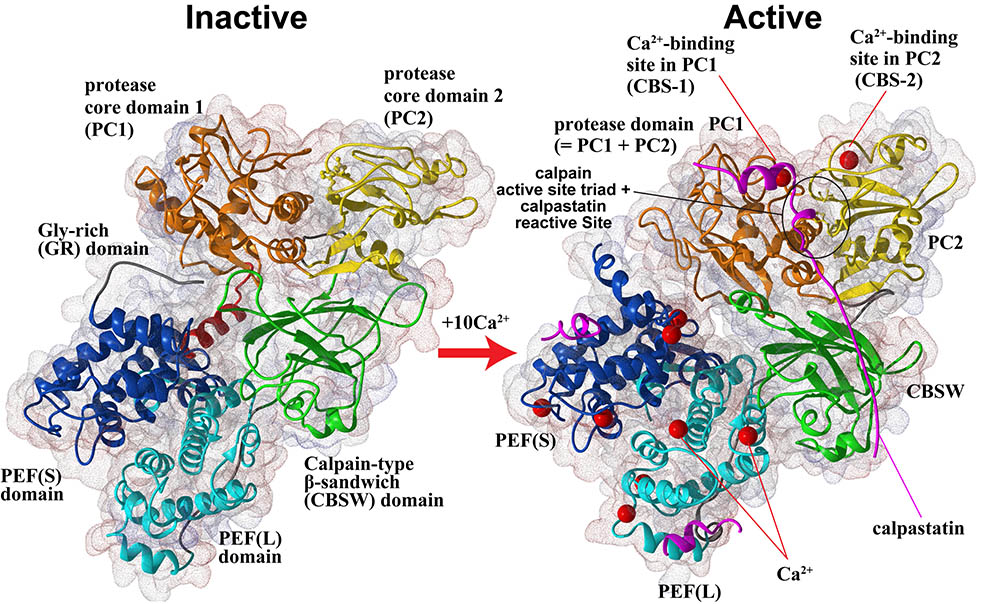
さらに、共同研究により、m-カルパインの不活性型の立体構造(図2、左の構造)を決定し、その知見を用いてカルパイン活性化機構の解析も行っています。
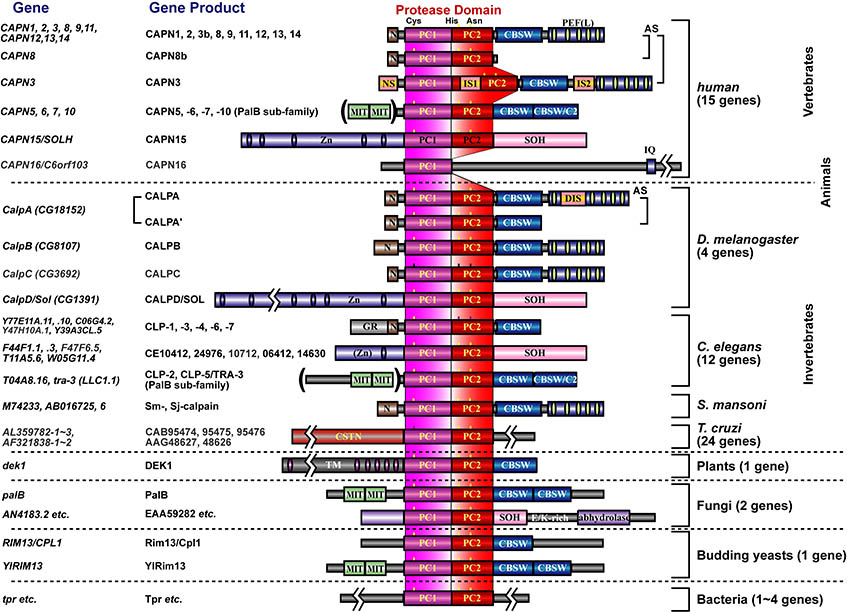
上述のようにヒトは15のカルパイン遺伝子をもっていますが、その代表的な遺伝子産物を下図に示しました。この中で、CAPN1及びCAPN2は古くから研究されているため"conventional calpains"と呼ばれ、他の全てのカルパインは"unconventional calpains"と呼ばれます。CAPN1及びCAPN2の構造は図1, 3に有るように、プロテアーゼドメイン(CysPcドメインと呼びます。2つのプロテアーゼ・コアドメイン(PC1及びPC2)に分かれます)、カルパイン型βサンドイッチドメイン(CBSWドメイン)、及びペンタEF-ハンドドメイン(PEFドメイン)の3つのドメインを持ちますが、他に、CAPN3, 8, 9, 11, 12, 13, 14も同様の構造を持つため、これらを総合して、"classical calpains"と呼びます(図3)。他のカルパインはC2LまたはPEFドメインの一方または両方を持っておらず、"non-classical calpains"と呼ばれます。以上は構造による分類ですが、一方、発現組織によっても、組織普遍的カルパイン(CAPN1, 2, 5, 7, 10, 13, 14, 15, 16)及び組織特異的カルパイン(CAPN3, 6, 8, 9, 11, 12)と2つに分類することもできます(図3)。
私たちは、unconventional calpainsの中でも組織特異カルパインと酵母からヒトまで保存されているCAPN7に注目をして研究を進めています。
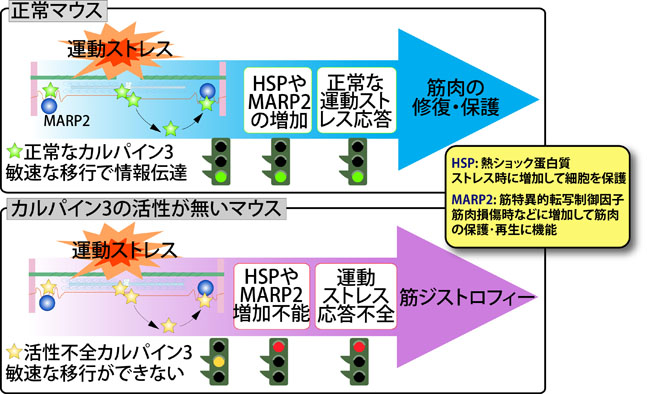
CAPN3についてはまず、翻訳直後に急速かつ徹底的な自己消化を起こし半減期10分未満で消滅するという、極めて特異な性質を見出しました。また、CAPN3の相互作用分子を探索した結果、筋原線維中の巨大弾性タンパク質であるコネクチン(タイチン)の特定部位と特異的結合を示すことを見出しました。そこで、コネクチンの相互作用因子を解析した結果、α-アクチニン、テレソニン(T-cap)、MuRFs、MARPsなどの興味深い分子との部位特異的相互作用を見出し、コネクチンをベースとした骨格筋細胞内シグナル伝達系の存在を明らかとしました。CAPN3とコネクチンの相互作用は骨格筋機能を考える上で興味深く、以下で述べるCAPN3の筋ジストロフィー責任遺伝子産物としての同定とも相まって、CAPN3の機能解析が国際的に隆盛となってきました。 1995年にフランスのグループが、CAPN3の遺伝子変異が肢帯型筋ジストロフィー2A型(LGMD2A、カルパイノパチーとも呼ばれる)の原因となることを報告しました。これはCAPN3が骨格筋機能に必須であることを明示しており、以降、CAPN3の研究はLGMD2Aの分子機構との関連において、大きく発展を遂げます。私たちは、生化学的解析及び遺伝子改変マウス(トランスジェニックマウス、ノックアウトマウス、及び、CAPN3のプロテアーゼ不活性分子(CAPN3:C129S)のノックインマウス)による解析の両面から、CAPN3のプロテアーゼ活性欠損がLGMD2Aを引き起こすという重要な知見を得ました。さらに、CAPN3は筋原線維上及び細胞質間をダイナミックに局在を活性依存的に変化させており、この機能が骨格筋のストレス応答に重要であることを見出しました(図4、詳細はこちら)。
同時にCAPN3の生化学的解析も並行して進め、強力な自己分解活性のためにタンパク質としては極めて扱いにくかったCAPN3について、その酵素学的性質を明らかとして、酵母遺伝学を用いた活性測定法を確立し、CAPN3がCa2+のみならず、Na+によっても活性化される、細胞内で初めてのNa+-依存性酵素であることを見出しました(詳細はこちら)。
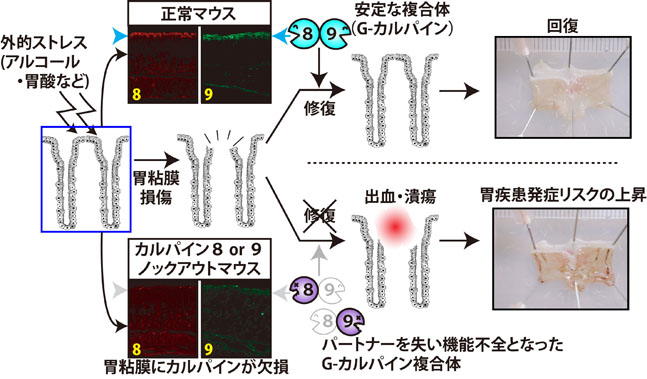
また、胃腸特異的カルパインCAPN8及びCAPN9については、1993年及び1998年に発見してから長らくその生理機能は不明でありました。これらについても、ノックアウト及びノックイン(CAPN8:C105S)マウスを作出して解析した結果、どちらもストレスに応答する胃粘膜防御機構に必須であり、どちらか一方でも欠損するとストレス性胃出血傾向が現れることを見出しました。さらに興味深いことに、CAPN8及びCAPN9は1:1の複合体を形成して、互いに他を安定化しており、一方の欠損により他方もダウンレギュレーションを受けることが明らかとなりました。即ち、CAPN8及びCPAN9はin vivo(胃)では複合体として機能していることが考えられ、これをG-カルパイン(G: gastric(胃))と命名しました(図5、詳細はこちら)。
さらに、ヒトCAPN8及びCAPN9の各遺伝子で報告されているアミノ酸置換を伴う一塩基多型(SNP)の中には、ナンセンス変異(CAPN8:Q386stop)やカルパインファミリーで高く保存されたアミノ酸残基の変異(CAPN9:A102V, R277W)が含まれており、CAPN8やCAPN9の機能に影響が及ぶことが考えられたました。私たちはこれらのSNPsについてin vitroでプロテアーゼ活性を調べたところ、上記のアミノ酸残基を含めた数種で活性の減弱・消失を認めました。CAPN9:R277は、LGMD2A型でのCAPN3の病因性変異が生じる箇所にも相当する。すなわち、CAPN8またはCAPN9に特定のSNPを有するヒトでは、G-カルパインの機能不全によってアルコールなどの外的ストレスに対する胃粘膜の抵抗性が低下しており、症状の慢性化・重篤化のリスクが高まる可能性が示唆されています。 [3] その他のカルパインCAPN6, CAPN7, CAPN11, CAPN12 組織特異的カルパインであるCAPN6, CAPN11, CAPN12についても発現組織の恒常性に密接な機能を果たすことが強く予想されています。特に、CAPN6の場合は、発現が胎児筋及び胎盤と、時空間特異的に発現し、子宮頸ガン組織における発現亢進も報告されています。さらに、ヒトカルパインファミリーの中で、唯一プロテアーゼ活性中心CysがLysに置換した非プロテアーゼ型という特質をもち、培養細胞レベルで微少管の制御および細胞移動に関与するなど、ユニークな生理機能が報告されているため、これらの特質が時空間特異的機能とどのような関連を持つのか、組織における機能解析が待望されています。CAPN11及びCAPN12はそれぞれ精巣及び毛包という極めて特殊に分化した細胞に特異的に発現しており、 その組織における機能に興味が集まっています。 [今後の展望] まず、私たちが発見した骨格筋特異的カルパインCAPN3について、発見から20年以上、筋ジストロフィーとの関連が見出されてからも既に15年以上経過していますが、強力な自己分解活性というユニークな性質故に、研究が難渋していました。しかし、遺伝学、プロテオーム解析、構造シミュレーションなどのバイオインフォマティクス解析を用いて、CAPN3の構造機能相関を明らかとしていき、LGMD2Aの発症分子機構を明確にしたいと考えています。 また、胃特異的カルパインについてはマウスにおいては、その欠損による表現型が胃のストレス応答による出血・潰瘍と関係することを明らかにしましたが、今後はこれらの知見を用いて、ヒトの現代病の大きな部分を占める胃疾患の分子機構に関して、ピロリ菌との関連やSNP解析により、解析していきたいと考えています。 さらに、他のカルパインも含めた知見の蓄積により、15種類あるヒトのカルパインをネットワークとしてとらえて、細胞機能の根底を担うカルパインシステムの全貌を、生化学的、分子遺伝学的、細胞生物学的、そして構造生物学的な解析など様々な角度からのアプローチにより、明らかにすることができたら、とても嬉しいことだと考えています。 |
Contact
公益財団法人 東京都医学総合研究所 基礎医科学研究分野 カルパインプロジェクト
プロジェクトリーダー 小野 弥子
〒156-8506 東京都世田谷区上北沢2-1-6 FAX: 03-5316-3163
E-mail:
URL: http://www.igakuken.or.jp/calpain/