プロトコル
成熟ラット脊髄後根神経節 (DRG) ニューロンの分散培養法とその応用
東京都医学総合研究所・糖尿病性神経障害プロジェクト
三五一憲、高久静香、新見直子、八子英司、赤嶺友代
はじめに
末梢感覚神経細胞である脊髄後根神経節 (dorsal root ganglion (DRG)) ニューロンの分散培養は、胎生・新生動物のみならず成熟動物においても可能であり1、神経の可塑性、老化や疾患に伴う神経機能障害等を評価する上で有用な実験系である2。我々はこの培養系をストレプトゾトシン糖尿病マウスやGM2ガングリオシド蓄積症 (Sandhoff病) モデルマウスに適用して、代謝異常に伴う神経細胞の接着、生存、神経突起伸長等の変化について検討してきた3-5。また成熟ラットDRGニューロンの培養系を用いて、神経再生を促進もしくは制御する因子の作用機構解明を目指している6-8。さらに株化シュワン細胞との共培養系を確立し、髄鞘形成を促進する因子の作用機構や、薬剤などによる脱髄誘導の病態を解析している5,9,10。
本稿では、当プロジェクトで用いている成熟ラットDRG ニューロンの分散培養法について、試薬、器具等を含めて詳しく紹介する。
機器・試薬等
1. 機器類
クリーンベンチ、位相差顕微鏡、CO2インキュベーター、振とう恒温槽、実体顕微鏡、遠心機等(通常の培養実験室内に設置)
2. 器具類
細胞培養ディッシュ (Corning 353001, 353002等)、12穴プレート (Greiner, 665180)、8穴チャンバースライド (Lab-Tek Chamber Slide: Nunc, 177445)、15 mL遠心チューブ、パスツールピペット及びシリコンスポイト(滅菌)、はさみ(外科直剪刀、眼科用剪刀(1本は骨切り専用にする))、ピンセット、精密ピンセット(INOX No.5)、マイクロレザーホルダー、剃刀(フェザーハイステンレス両刃)等
註1)細胞を撒布するディッシュ、プレート、チャンバースライド等は、あらかじめポリリジン(poly-L-lysine: Sigma, P1524, 10 μg/mL)等の基質を底面にコートして使用する(図1A)。チャンバースライドは神経突起伸長の評価に有用なだけでなく、免疫染色にも便利である。またアクラフィルム (254 mm x 200 mm: 日新EM) を9 mm径の正円に打ち抜き、ポリリジンで培養ディッシュに貼付けたもの(図1B)を免疫染色や電顕用に使用している。
図1
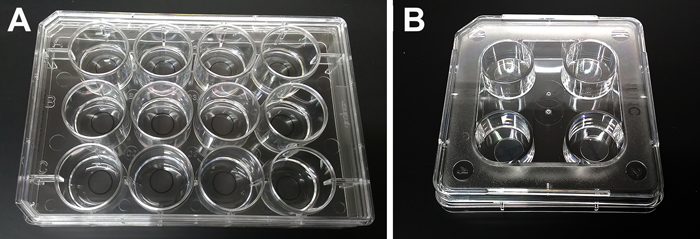
ポリリジンコート中の12穴プレート (A) とポリリジンで4穴プレートに貼付けたアクラ(B)
(註2)剃刀は3-5 mm幅となるよう短冊状に切断し、マイクロレザーホルダーに取り付ける(図2)。実体顕微鏡下に神経節から線維束を切断する際に使用する。
図2
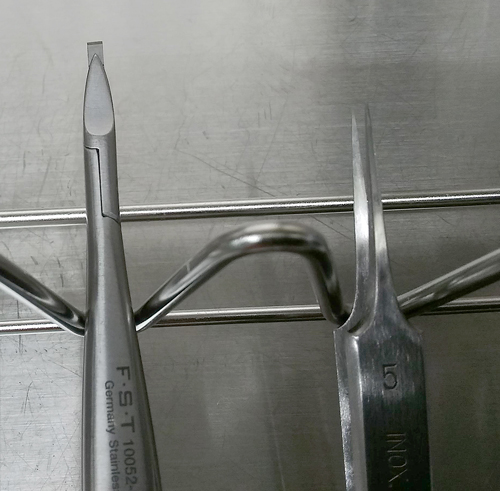
マイクロレザーホルダー(左)と精密ピンセット [INOX No.5](右)。マイクロレザーホルダー先端には、短冊状にカットされた剃刀が取り付けられている。
3. 培養液・試薬等
- DMEM/F12合成培地 (DMEM/Ham’s F-12: ThermoFisher Scientific, 11330-032)
- ウシ胎仔血清 (Fetal Bovine Serum (FBS): ThermoFisher Scientific)
補体不活化 (56°C, 30分:製品によっては不要) 後、適量に分注して冷凍保存 - 無血清試薬 (B27 supplement, 50x: ThermoFisher Scientific, 17504044)
- 抗生物質(Antibiotic-Antimycotic solution, 100x: Sigma, A5955)
- Hanks液 (Hanks’ balanced salt solution (HBSS), 1x: Sigma, H9394)
- ポリリジン
滅菌水で1 mg/mLに調製しフィルター濾過後、冷凍保存 (100倍ストック)
使用時はさらに10 μg/mLに希釈し、冷蔵保存 - コラゲナーゼ (collagenase type III: Worthington, CLS3)
DMEM/F12で10 mg/mLに調製しフィルター濾過後、適量に分注して冷凍保存 - トリプシン (trypsin type I: Sigma, T8003)
Hanks液で10 mg/mLに調製しフィルター濾過後、適量に分注して冷凍保存 - トリプシンインヒビター (trypsin inhibitor, Sigma, T9003)
Hanks液で50 μg/mLに調製しフィルター濾過後、適量に分注して冷蔵保存 - パーコール(Percoll; GE Healthcare, 17089102)
Hanks液で30%に希釈し、冷蔵保存
(例:Percoll 30 mL + 10x HBSS (Sigma, H4385) 3.3 mL + 1x HBSS 67 mL)
(註1)ポリリジンは、ディッシュの中央部(細胞を撒布する部位)が広くコーティングされるように加える。クリーンベンチ内で30分放置したあと、パスツールピペットやディスポスポイト等で吸い取り、そのままディッシュを乾燥させる(滅菌水等で洗う必要はない)。
(註2)神経成長因子(nerve growth factor (NGF))は培養初期の神経突起伸長を促進するが、成熟動物DRGニューロンの生存維持に必須の因子ではない11ので、培地に添加する必要はない。
DRGニューロンの分散培養
生後8-12週のラットより胸腰髄レベルのDRGを摘出する。1匹のラットから約30個の神経節を採取できる(パッチクランプ等の機能解析や光顕、電顕レベルでの形態観察の場合は、10個程度で解析に充分な数のニューロンが得られる)。
- 脊椎(胸部〜腰部)を一塊として切り出し、周囲の結合組織をハサミで除去する。背側を表にして、吻側から尾側に向けてハサミ(骨切用)を入れ脊柱管を切り開いた後、脊髄をピンセットで除去する。次に骨切用ハサミで脊椎腹側中央を切り進め、ほぼ左右対称となるように折半する。実体顕微鏡下に神経節を確認し、精密ピンセット (INOX No.5) で1個ずつ摘出してDMEM/F12培養液を満たしたディッシュに入れる。(図3A)。この際神経節を傷つけないように、神経線維束をピンセットで軽くつまんで持ち上げるようにする。
- 摘出した神経節を実体顕微鏡下に観察しながら、マイクロレザーホルダー先端に取り付けた剃刀(図2)で、神経線維束を神経節に近い部位で切断して除く(図3B)。この処理により、ニューロンの回収率がより高くなる。
- 実体顕微鏡下に、神経線維束を伴ったDRGを精密ピンセットで摘出し、DMEM/F12培養液を満たしたディッシュに入れる。
- 実体顕微鏡で観察しながら、摘出したDRGを精密ピンセットでおさえ神経節(ニューロンの細胞体を含む)に近い部位に剃刀(図2)を当て、神経線維束を切断する。切断した線維束(上側ディッシュ)は廃棄し、回収した神経節(下側ディッシュ)のみを酵素処理する。
- パスツールピペットやシリコンスポイトを用いて神経節を15 mL遠心チューブ2本(約15個/本)に移し、各チューブ中の組織をDMEM/F12で2回リンスした後、2 mg/mL コラゲナーゼ溶液(10 mg/mL コラゲナーゼ 0.4 mL + DMEM/F12 1.6 mL)中でインキュベーションする [37°C、120分]。振とう恒温槽(図4)を用いれば、より効率的な酵素処理が行なえる。
- コラゲナーゼ処理後の神経節を遠心(180×g、3分)し、上清を捨てる。Hanks液で2回リンス(180×g、3分)した後、2.5 mg/mL トリプシン溶液(10 mg/mL トリプシン 0.5 mL + Hanks液 1.5 mL)中でインキュベーションする [37°C、15分]。
- トリプシンインヒビター (50 μg/mL) 150 μLを加え、バーナー等で先端を細くしたパスツールピペットもしくはキャピラリーを用いて、20-30回程度ゆっくりピペッティングする。充分な酵素処理がなされていれば、このピペッティング操作により組織塊はほぼ消失する(図5)。
- 30%パーコール 6 mLの入った15 mL遠心チューブを2本用意し、各チューブの上に酵素処理した神経節をゆっくり重層する。密度勾配遠心分離(180×g、5分)により、ニューロンとミエリン・その他の細胞とを分離する12(図6)。
- 回収したニューロンを血清入りの培養液 (DMEM/F12/10%FBS) で2回リンス (180×g、3分)した後、各チューブあたり2 mLのDMEM/F12/10%FBSにサスペンドし、ポリリジンコートした培養ディッシュやチャンバースライドに撒布する。撒布時の細胞密度が多すぎても少なすぎてもニューロンの生存や突起伸長の評価が困難になるので、常にほぼ一定の密度となるように注意する。株化細胞や胎仔大脳皮質ニューロン等に比べ得られるニューロンの数が少ないため、血算盤では正確な細胞数計測が困難である。我々はアクラ1枚に100 μLの細胞浮遊液を滴下して、細胞密度の確認・調整を行なっている。
- 細胞を撒布したディッシュを37°CのCO2インキュベーターに入れ一晩放置した後、血清入りもしくは無血清培養液 (DMEM/F12/B27) をディッシュに加える。培養液は2〜3日毎に交換する。
図3.摘出したDRG の処理
図4.振とう恒温槽を用いた酵素処理

図5

トリプシン処理後、チューブ底面にDRGの組織塊が確認できる (A) が、ピペッティング操作後にはほぼ溶解している (B)。
図6.パーコールを用いた密度勾配遠心分離

30%パーコール 6 mLの上に分散した組織を静かに加え (A:白線部分)、遠心分離。ニューロン以外の細胞やミエリンはその大部分が上層に残る一方、ニューロンの多くは最下層(ペレット)に移る (B)。
(註1)1匹のラットから摘出した約30個のDRGを上記処理することにより、5×104個以上のニューロンが得られる。パーコールを用いた密度勾配遠心分離により、ニューロンと他の細胞をある程度選別することができ、純度の高いニューロンの培養系が得られる12。
(註2)DRGニューロンは、位相差顕微鏡下で光沢を有し(phase-bright; 図7A,B)細胞体径が20-30 μmと大きいことから、シュワン細胞や線維芽細胞等との識別が容易である。ニューロンの同定ならびに形態観察には、100%メタノールや酸アルコール(95%エタノール/5%酢酸)等のアルコール系固定液で固定した後、ニューロンに特異的なマーカーに対する抗体(特に抗βIII tubulin抗体 (Sigma, T8660); 図7C)で免疫染色すればよい。
図7.成熟ラットDRG ニューロンの光顕像
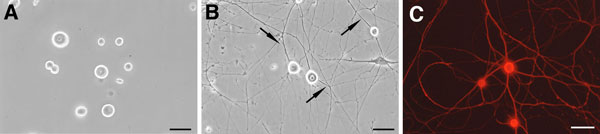
- 培養3時間後の位相差顕微鏡像。まだ神経突起の形成はみられていない。
- 培養7日後の位相差顕微鏡像。ニューロンの細胞体から神経突起(矢印)が伸長している。N2や B27サプリメントを用いた無血清培養液で維持することにより、線維芽細胞等の増殖を抑制できる。
- (A) 培養7日後のニューロンを抗βIII tubulin抗体で免疫染色した像。(Barはいずれも50 μm)
機能解析
細胞生存能:ディッシュや12穴プレート底面に描いた1cm 径正円枠内のニューロン数を継時的に数えることにより、生存率の推移を求める8,9。光沢を失った細胞や細胞膜が明瞭でなくなった細胞は、死細胞とみなしカウントしない。最終計測時に、トリパンブルーの取り込みの有無で細胞死を判定する。
神経突起伸長能:神経突起は生細胞を位相差顕微鏡下に観察するか、抗βIII tubulin抗体で免疫染色してから計測する。細胞体以上の長さの神経突起を有するニューロンを有突起細胞(neurite-bearing cells)として、その全細胞に占める割合を算出する。また有突起細胞50-100個の神経突起長をMetamorph (Molecular Devices, Inc., Sunnyvale, CA, USA) 等の画像解析ソフトを用いて測定し、その平均値を神経突起長(average neurite length)として表す7-9。
パッチクランプ、カルシウムイメージング等:DRGニューロンは細胞体が大きくイオンチャネルも豊富に存在するため、パッチクランプ等の電気生理学的解析や細胞内カルシウム測定に極めて有用である。詳しくは個々の文献を参照のこと13-15。
形態解析
免疫染色(多重染色を含む)、電顕(透過、走査)、免疫電顕等へのアプローチが容易で、細胞体ならびに神経突起が鮮明に描出できる。詳しくは個々の文献を参照のこと3,9,16。
分子生物学・生化学的解析
リアルタイムRT-PCRによる遺伝子発現解析は可能である17が、シュワン細胞等の混入は避けられないので、結果の解釈には注意を要する。また株化細胞等に比べて得られるニューロンの数が少ないので、マイクロアレイ解析やWestern blottingのように一定量のRNA・蛋白質を必要とする解析は困難もしくは労力を要する。我々は時に2匹のラットから80-90個の神経節を回収して分散培養し、ニューロンの高密度培養系からタンパクを抽出してWestern解析をおこなっている7,16。
遺伝子導入やRNA干渉等によるノックダウンの実験は幼若動物由来のニューロンに比べ難度が高くなるが、成功例も報告されている17-20。
おわりに
成熟ラットDRGニューロンの分散培養法と、得られたニューロンを用いた種々の解析手法について概説した。マウスについても同様の手法で培養できる。培養手技自体はさほど難しくないので、1ヶ月も練習すれば習得できるであろう。培養ニューロンから得られた結果が生体内での現象をどこまで反映しているか、その評価には常に慎重でなければならない。しかしながら in vivo の系では困難な細胞機能の検討が容易におこなえる点で本培養系は有用であり、成熟期以降の疾患モデル動物に適用できるという利点は大きい4,5。再生、老化、末梢神経疾患等の病態解明や治療法開発に、この培養系を役立てていただきたい。
文献
- Scott BS. Adult mouse dorsal root ganglion neurons in cell culture.
J Neurobiol 1977; 8: 417-27.
- Horie H, Kawasaki Y, Takenaka T. Lateral diffusion of membrane lipids changes with aging in C57BL mouse dorsal root ganglion neurons from a fetal stage to an aged stage.
Brain Res 1986; 377: 246-50.
- Sango K, Yamanaka S, Ajiki K, Tokashiki A, Watabe K. Lysosomal storage results in impaired survival but normal neurite outgrowth in dorsal root ganglion neurones from a mouse model of Sandhoff disease.
Neuropathol Appl Neurobiol 2002; 28: 23-34.
- Sango K, Saito H, Takano M, Tokashiki A, Inoue S, Horie H. Cultured adult animal neurons and Schwann cells give us new insights into diabetic neuropathy.
Curr Diabetes Rev 2006; 2: 169-83.
- Sango K, Niimi N, Tsukamoto M, Utsunomiya K, Sakumi K, Nakabeppu Y, Kadoya T, Horie H. What have we learned from cultured adult dorsal root ganglion neurons? In:
Ganglion Cells: Morphology, Functional Development and Role in Disease (Ed: Vlastimil LG), Nova Science Publishers, Inc, Hauppauge, USA, 2014; pp.125-148.
- Sango K, Oohira A, Ajiki K, Tokashiki A, Horie M, Kawano H. Phosphacan and neurocan are repulsive substrata for adhesion and neurite extension of adult rat dorsal root ganglion neurons in vitro.
Exp Neurol 2003; 182: 1-11.
- Takaku S, Yanagisawa H, Watabe K, Horie H, Kadoya T, Sakumi K, Nakabeppu Y, Poirier F, Sango K. GDNF promotes neurite outgrowth and upregulates galectin-1 through the RET/PI3K signaling in cultured adult rat dorsal root ganglion neurons.
Neurochem Int 2013; 62: 330-339.
- Tsukamoto M, Niimi N, Sango K, Takaku S, Kanazawa Y, Utsunomiya K. Neurotrophic and neuroprotective properties of exendin-4 in adult rat dorsal root ganglion neurons: involvement of insulin and PI3 kinase/RhoA signaling.
Histochem Cell Biol 2015; 144: 249-259.
- Sango K, Yanagisawa H, Kawakami E, Takaku S, Ajiki K, Watabe K. Spontaneously immortalized Schwann cells from adult Fischer rat as a valuable tool for exploring neuron-Schwann cell interactions.
J Neurosci Res 2011; 89: 898–908.
- Niimi N, Yako H, Tsukamoto M, Takaku S, Yamauchi J, Kawakami E, Yanagisawa H, Watabe K, Utsunomiya K, Sango K. Involvement of oxidative stress and impaired lysosomal degradation in amiodarone-induced schwannopathy.
Eur J Neurosci 2016; 44: 1723-33.
- Lindsay RM. Nerve growth factors (NGF, BDNF) enhance axonal regeneration but are not required for survival of adult sensory neurons.
J Neurosci 1988; 8: 2394-405.
- Goldenberg SS, De Boni U. Pure population of viable neurons from rabbit dorsal root ganglia, using gradients of Percoll.
J Neurobiol 1983; 14: 195-206.
- Hirade M, Yasuda H, Omatsu-Kanbe M, Kikkawa R, Kitasato H. Tetrodotoxin-resistant sodium channels of dorsal root ganglion neurons are readily activated in diabetic rats.
Neuroscience 1999; 90: 933-9.
- Sanada M, Yasuda H, Omatsu-Kanbe M, Sango K, Isono T, Matsuura H, Kikkawa R. Increase in intracellular Ca(2+) and calcitonin gene-related peptide release through metabotropic P2Y receptors in rat dorsal root ganglion neurons.
Neuroscience 2002; 111: 413-22.
- Ibi M, Matsuno K, Shibata D, Katsuyama M, Iwata K, Kakehi T, Nakagawa T, Sango K, Shirai Y, Yokoyama T, Kaneko S, Saito N, Yabe-Nishimura C. Reactive oxygen species derived from NOX1/NADPH oxidase enhance inflammatory pain.
J Neurosci 2008; 28: 9486-94.
- Sango K, Yanagisawa H, Takaku S. Expression and histochemical localization of ciliary neurotrophic factor in cultured adult rat dorsal root ganglion neurons.
Histochem Cell Biol 2007; 128: 35-43.
- Dodge ME, Wang J, Guy C, Rankin S, Rahimtula M, Mearow KM. Stress-induced heat shock protein 27 expression and its role in dorsal root ganglion neuronal survival.
Brain Res 2006; 1068: 34-48.
- Miao T, Wu D, Zhang Y, Bo X, Subang MC, Wang P, Richardson PM. Suppressor of cytokine signaling-3 suppresses the ability of activated signal transducer and activator of transcription-3 to stimulate neurite growth in rat primary sensory neurons.
J Neurosci 2006; 26: 9512-9.
- Seijffers R, Allchorne AJ, Woolf CJ. The transcription factor ATF-3 promotes neurite outgrowth.
Mol Cell Neurosci 2006; 32: 143-54.
- Sabbir MG, Fernyhough P. Muscarinic receptor antagonists activate ERK-CREB signaling to augment neurite outgrowth of adult sensory neurons.
Neuropharmacology 2018; 143: 268-81.
- Scott BS. Adult mouse dorsal root ganglion neurons in cell culture.
J Neurobiol 1977; 8: 417-27. - Horie H, Kawasaki Y, Takenaka T. Lateral diffusion of membrane lipids changes with aging in C57BL mouse dorsal root ganglion neurons from a fetal stage to an aged stage.
Brain Res 1986; 377: 246-50. - Sango K, Yamanaka S, Ajiki K, Tokashiki A, Watabe K. Lysosomal storage results in impaired survival but normal neurite outgrowth in dorsal root ganglion neurones from a mouse model of Sandhoff disease.
Neuropathol Appl Neurobiol 2002; 28: 23-34. - Sango K, Saito H, Takano M, Tokashiki A, Inoue S, Horie H. Cultured adult animal neurons and Schwann cells give us new insights into diabetic neuropathy.
Curr Diabetes Rev 2006; 2: 169-83. - Sango K, Niimi N, Tsukamoto M, Utsunomiya K, Sakumi K, Nakabeppu Y, Kadoya T, Horie H. What have we learned from cultured adult dorsal root ganglion neurons? In:
Ganglion Cells: Morphology, Functional Development and Role in Disease (Ed: Vlastimil LG), Nova Science Publishers, Inc, Hauppauge, USA, 2014; pp.125-148. - Sango K, Oohira A, Ajiki K, Tokashiki A, Horie M, Kawano H. Phosphacan and neurocan are repulsive substrata for adhesion and neurite extension of adult rat dorsal root ganglion neurons in vitro.
Exp Neurol 2003; 182: 1-11. - Takaku S, Yanagisawa H, Watabe K, Horie H, Kadoya T, Sakumi K, Nakabeppu Y, Poirier F, Sango K. GDNF promotes neurite outgrowth and upregulates galectin-1 through the RET/PI3K signaling in cultured adult rat dorsal root ganglion neurons.
Neurochem Int 2013; 62: 330-339. - Tsukamoto M, Niimi N, Sango K, Takaku S, Kanazawa Y, Utsunomiya K. Neurotrophic and neuroprotective properties of exendin-4 in adult rat dorsal root ganglion neurons: involvement of insulin and PI3 kinase/RhoA signaling.
Histochem Cell Biol 2015; 144: 249-259. - Sango K, Yanagisawa H, Kawakami E, Takaku S, Ajiki K, Watabe K. Spontaneously immortalized Schwann cells from adult Fischer rat as a valuable tool for exploring neuron-Schwann cell interactions.
J Neurosci Res 2011; 89: 898–908. - Niimi N, Yako H, Tsukamoto M, Takaku S, Yamauchi J, Kawakami E, Yanagisawa H, Watabe K, Utsunomiya K, Sango K. Involvement of oxidative stress and impaired lysosomal degradation in amiodarone-induced schwannopathy.
Eur J Neurosci 2016; 44: 1723-33. - Lindsay RM. Nerve growth factors (NGF, BDNF) enhance axonal regeneration but are not required for survival of adult sensory neurons.
J Neurosci 1988; 8: 2394-405. - Goldenberg SS, De Boni U. Pure population of viable neurons from rabbit dorsal root ganglia, using gradients of Percoll.
J Neurobiol 1983; 14: 195-206. - Hirade M, Yasuda H, Omatsu-Kanbe M, Kikkawa R, Kitasato H. Tetrodotoxin-resistant sodium channels of dorsal root ganglion neurons are readily activated in diabetic rats.
Neuroscience 1999; 90: 933-9. - Sanada M, Yasuda H, Omatsu-Kanbe M, Sango K, Isono T, Matsuura H, Kikkawa R. Increase in intracellular Ca(2+) and calcitonin gene-related peptide release through metabotropic P2Y receptors in rat dorsal root ganglion neurons.
Neuroscience 2002; 111: 413-22. - Ibi M, Matsuno K, Shibata D, Katsuyama M, Iwata K, Kakehi T, Nakagawa T, Sango K, Shirai Y, Yokoyama T, Kaneko S, Saito N, Yabe-Nishimura C. Reactive oxygen species derived from NOX1/NADPH oxidase enhance inflammatory pain.
J Neurosci 2008; 28: 9486-94. - Sango K, Yanagisawa H, Takaku S. Expression and histochemical localization of ciliary neurotrophic factor in cultured adult rat dorsal root ganglion neurons.
Histochem Cell Biol 2007; 128: 35-43. - Dodge ME, Wang J, Guy C, Rankin S, Rahimtula M, Mearow KM. Stress-induced heat shock protein 27 expression and its role in dorsal root ganglion neuronal survival.
Brain Res 2006; 1068: 34-48. - Miao T, Wu D, Zhang Y, Bo X, Subang MC, Wang P, Richardson PM. Suppressor of cytokine signaling-3 suppresses the ability of activated signal transducer and activator of transcription-3 to stimulate neurite growth in rat primary sensory neurons.
J Neurosci 2006; 26: 9512-9. - Seijffers R, Allchorne AJ, Woolf CJ. The transcription factor ATF-3 promotes neurite outgrowth.
Mol Cell Neurosci 2006; 32: 143-54. - Sabbir MG, Fernyhough P. Muscarinic receptor antagonists activate ERK-CREB signaling to augment neurite outgrowth of adult sensory neurons.
Neuropharmacology 2018; 143: 268-81.


