Reserch - Influenza Virus
Influenza Virus
インフルエンザウイルスとは?
インフルエンザウイルスは過去に4度世界的に大流行し、また高病原性鳥インフルエンザウイルスH5N1(H5N1 HPAIV)や世界的流行を起こしたパンデミックH1N12009インフルエンザウイルス(パンデミックH1N12009)、更に毎年流行する季節性インフルエンザウイルスによる感染症は健康、及び世界経済に深刻な影響を与え続けている。過去に発生した世界的な大流行は、人類が未経験の鳥インフルエンザウイルスのHA(Hemagglutinin)遺伝子がヒトの間で流行していたインフルエンザウイルスのHA遺伝子と組変わること(遺伝子再集合)に起因する。インフルエンザプロジェクトでは、H5N1 HPAIVやパンデミックH1N12009等、近年ヒトでの感染が報告されている新型インフルエンザウイルスに対する予防法及び治療法の開発に取り組んでいる。特に、H5N1 HPAIVは、東南アジア、中東、エジプトを中心に毎年ヒトでの感染例と死亡例が報告されており、その致死率は約60%と非常に高く、人為的、又は自然発生的な世界的大流行が危惧されている。さらに、2013年になって中国で流行している鳥インフルエンザH7N9亜型の致死率も20%と高く、これも大流行が危惧されており、これらの世界的大流行に備えた対策の強化が必須となっている。しかし、H5N1 HPAIVの遺伝子は年々変異しており、抗原性の異なるウイルス株が多数存在し、その遺伝子配列から複数のクレードに分類されている。その為、世界的大流行を引き起こすウイルス株を予測する事は非常に困難で、これらの変化に対応することが求められている。
病原性発現機序のウイルス学的・免疫学的解析:高病原性トリインフルエンザウイルス感染に対する宿主免疫低応答性機序の解析
ヒトへのH5N1高病原性トリインフルエンザウイルス(H5N1 HPAIV)感染は、東南アジア諸国とエジプトを中心に600人以上が報告され、致死率は約60%にも至る。H5N1 HPAIV感染では、肺組織中ウイルス量と重症化が相関し、ウイルスを排除できずに死亡している症例が多く存在する。
これまでに、高病原性発現に関わるインフルエンザウイルス蛋白質のアミノ酸変異が、複数報告されている。RNAポリメラーゼ複合体の構成成分の一つであるPB2蛋白質の627番目のリジンへの変異は、哺乳類動物でのウイルス増殖性と致死性を高める。非構造蛋白質であるNS1蛋白質は、ウイルスRNA認識センサーであるRIG-Iと結合し、タイプIインターフェロンの産生を抑制する。また、PB1-F2蛋白質の66番目のセリンへの変異もインターフェロン応答性遺伝子の発現抑制に関与する。しかし、これら病原性発現に関わるアミノ酸変異を有していないH5N1 HPAIV株も多く存在する。更に、H5N1 HPAIVのヘマグルチニン(HA)蛋白質が有する多塩基性開裂部位は、ウイルスの全身指向性には関わるが、肺組織での過剰なウイルス増殖への影響は不明である。従って、既知のウイルス因子のみでは、H5N1 HPAIV感染による高病原性発現機序を完全には説明し切れていない。一方で、H5N1 HPAIVに対するワクチンは、従来の季節性インフルエンザと同一方法で作製されたスプリットワクチンでは抗体誘導能が非常に低い。また、H5N1 HPAIV感染による重篤患者への快復患者由来の血漿投与による治療効果が報告されている。これらの結果から、抗原特異的抗体がH5N1 HPAIV排除に重要な役割を果たしている事が示唆される。
この時、パンデミックH1N12009は、液性免疫産生時期に相関して肺組織中から急激に排除されるのに対して、H5N1 HPAIVは、肺組織中ウイルス量が増加していき、重症肺炎を発症させて宿主を死に至らしめる。そこで、H5N1 HPAIV由来HA蛋白質に対する抗体誘導能が低応答化する機序について解析を進めている。
予防法の確立:組換え生ワクチンの開発
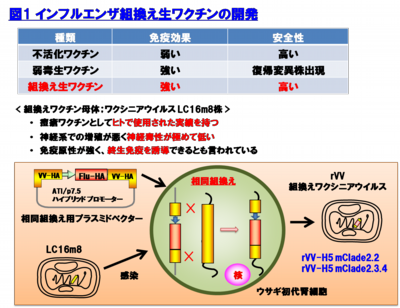
新型インフルエンザウイルスに対する予防法の確立を目指し、既存のワクチンとは異なる新規インフルエンザワクチンの作製を行っている。ヒトでの使用実績を有するウイルス母体に目的外来蛋白質を発現させた組換え生ワクチンは、高い安全性及び優れた免疫誘導能を有している。そこで、我々は、天然痘ワクチンとして日本で承認され、乳幼児に対して使用実績を有するワクシニアウイルス(LC16m8)を母体としたH5N1 HPAIVのヘマグルチニン蛋白質発現組換え生ワクチン(rVV-HA Flu)を開発し、モデル動物での防御効果を検討している(図1)。
パンデミックH1N12009インフルエンザの世界的大流行からも分かるように一度新型インフルエンザがヒトの間で感染拡大が起こると短期間のうちに世界中に広がってしまう。そこで、現状では限局的なヒトでの感染に止まっているH5N1 HPAIVやこれまでにヒト間で流行が起きていない新型ウイルスが万が一ヒト間で感染拡大が起こった際には、単回接種で短期間の内に強力に免疫誘導できるワクチンが必要であると考えられる。
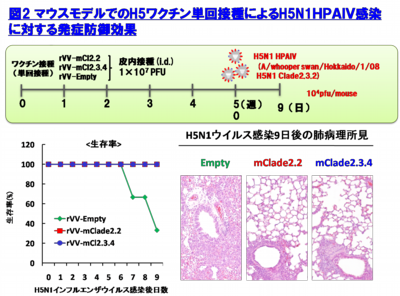
BALB/cマウスの皮内にrVV-HA Fluを単回接種し、その後H5N1 HPAIVによる致死性攻撃感染を行った(図2)。ワクチン非接種では、重症肺炎を発症して高い致死性を示しましたが、ワクチン接種群では、肺炎像はほとんど認められず、100%の生存できる事が判明した。また、本ワクチンは、H5N1 HPAIVによる攻撃感染の1週間前での単回接種で致死性ウイルス感染を100%防御できる事や国内で備蓄されている全粒子不活化H5N1プレパンデミックワクチンでは発症防御効果が弱いとされるクレードの異なるウイルス株に対しても強力な発症防御効果を発揮する事が明らかとなった。
更に、霊長モデルであるカニクイザルでの本インフルエンザ組換え生ワクチンの防御効果を検討した結果、ワクチン接種群では、肺組織中からの速やかなウイルス排除効果と顕著な肺炎軽減効果が認められた(図3と4)。
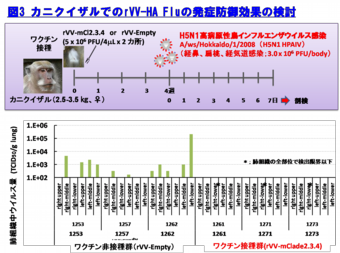
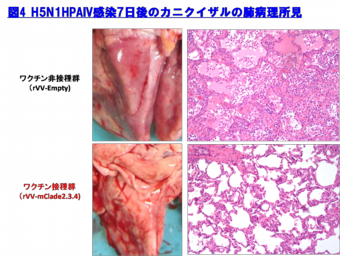
以上の結果より、rVV-HA Fluワクチンは、H5N1 HAPIVの世界的流行に備えた有効なワクチン候補となり得ると考えている。
今後は、本組換え生ワクチンによる発症防御機序の解析を進める一方で、季節性インフルエンザ用ワクチンの開発へと発展させていきたいと考えている。
治療法の確立:抗体医薬の開発
既存の抗インフルエンザ薬であるタミフルやリレンザといったノイラミニダーゼ阻害剤は、その効果が発症後48時間以内と限定的である事に加え、耐性ウイルスの出現が大きな問題となっている。治療が遅れた為にタミフル投与での治療効果が認められなかったH5N1HPAIV感染患者に対して、快復患者由来の血漿投与が劇的な治療効果を発揮したとの臨床報告は、抗インフルエンザ薬としての抗体医薬の可能性を示した。
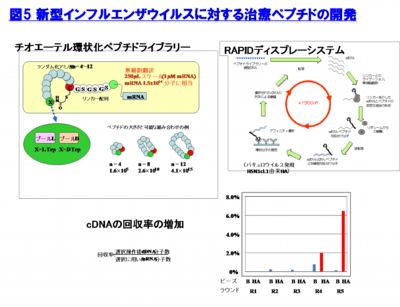
近年、第3世代の抗体医薬として特殊環状ペプチドが注目されている。特殊環状ペプチドはアミノ酸がメチル化されているものを用い、さらに環状化することにより、動物体内での安定性を100−1000倍に高めている。我々は、抗体よりも分子量が小さく、より特異的な標的部位への結合を可能とする特殊環状ペプチドに着目し、インフルエンザウイルスHA蛋白質を標的とした抗インフルエンザ薬の開発を進めている(図5)。
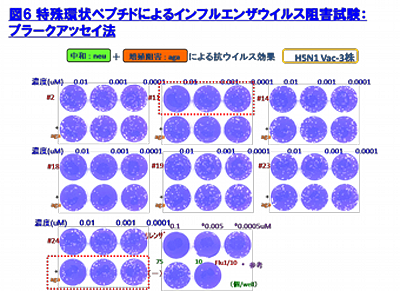
我々の研究の結果、H5N1 HPAIVのHA蛋白質に対する特殊環状ペプチドを24種得ることに成功し、その中でもiHA-24は、最も強力な抗インフルエンザ活性を有していた(図6)。

iHA-24のインフルエンザウイルスの増殖阻害活性の作用機序として、本ペプチドはインフルエンザウイルスの粒子表面のHA蛋白質に結合するため、ウイルス生活環においてHA蛋白質が関与する段階であるHA蛋白質の開裂、細胞への吸着、ウイルス膜と細胞膜との融合、ウイルス粒子形成、出芽であると想定される。そこで、iHA-24の阻害作用機序について詳細な解析を進めている。その一つの機序として、HA蛋白質への結合を介したウイルス粒子の中和活性(細胞への吸着阻害)に加え、細胞内での侵入に必須である細胞膜へのHA蛋白質による膜融合を阻害する活性を有することが明らかとなった(図7)。
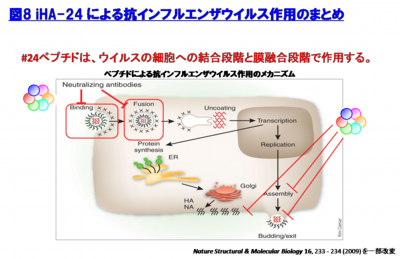
現在、このiHA-24が阻害し得るウイルス生活環の各段段階での解析を進めると共に、実験動物での治療効果の検討を進めている(図8)。

