HOME > 広報活動 > 刊行物 > Jul. 2014 No.014

Jul. 2014 No.014
特集
研究紹介
開催報告
お知らせ・編集後記
特集
病院等連携研究センターの発足にあたって
東京都医学総合研究所 病院等連携研究センター センター長石塚 典生

平成26年4月1日から病院等連携研究センターが発足しました。 医学研には、研究活動を支援するセンターとして開所当初から基盤技術センター(動物実験開発室、研究技術開発室)と知的財産活用センターがありますが、医学研の基礎研究の充実と研究成果の実用化をさらに進める支援組織として新たに設立されたものです。 組織としては、連携推進室と神経病理解析室の2室があります。 連携推進室は、生物統計、人を対象とする研究、実用化に向けた橋渡し研究、薬事、都立病院等との連携研究などに関する支援を行います。 神経病理解析室は、これまで活動していた脳病理標本リサーチセンターが新たにこの病院等連携研究センターに属することになったものです。 旧神経研・旧精神研の保有していた5,000例に及ぶ脳病理標本と医学研として新たに蓄積している脳病理標本をデジタル化データベースにするなどして、研究、診断、教育に活用しています(都医学研NEWS, No6に記載)。 今回は連携推進室について具体的に紹介します。
医学研で行われる研究の大半は基礎的研究で、毎年Nature、Cell、Scienceなどをはじめとして、それぞれの研究分野で評価の高い学術雑誌に多くの研究成果が発表されています。これらの中から社会に直接役立つ医薬品や医療機器などを開発する研究を発掘、支援し、実用化へ結びつけるのが連携推進室の目的です。研究成果の実用化とは、端的に言えば、国の製造承認を得て製品として世に出すことです。基礎研究に端を発する実用化への流れは、実用化研究開発(R&D)※1パイプラインと呼ばれます(図)。
図1
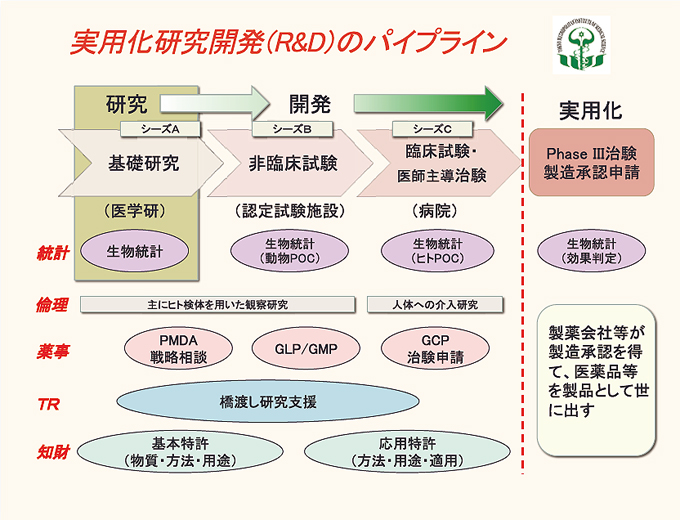
実用化に必要な手続きは多岐多様にわたっており、研究者が全て自分で行っていくのでは時間と労力をきわめて消耗することになり、研究そのものが遅延することにもなります。もちろん、開発研究も研究者が主体になっていかなければなりませんが、病院等連携研究センター・連携推進室の設置により、研究所としてこれらの開発の活動を組織的・計画的にサポートしていくことになります。
基礎研究で得られた発見を薬にする過程を見てみます。ある遺伝子が生体を害する物質を作る酵素をコーディングしていることを基礎研究で発見しました。そして、生体反応のどの段階を制御すれば人体への侵害作用を阻止できるかを見つけました。
まず、それらの研究成果の基本特許を取得します(シーズA)。実用化へ進む場合にはこれらの基本特許が無いと製薬会社は医薬品開発を引き受けてくれませんし、基礎研究においても、他からの掣肘を受けずに自分の研究を進めるためにも権利化する必要があります。
そして、次にこの酵素の阻害剤などを作成し、それが本当に有効か、毒性は無いかを動物実験で確認します。試験実験そのものは研究室でもできますが、この先薬事承認を得るためには、認定された試験施設で、決められた手順の下に行う必要があります(GLP非臨床試験)※2。この段階(シーズB)で薬になると判断されると(動物実験でのPOC)※3、実用化の可能性が出てきます。人での臨床試験に移るためには、この薬を認定された製造ラインで製造しなくてはいけません(GMP製造)※4。この段階以降では、実際に薬を製造・販売してくれる製薬会社ヘの委託が必須です。製薬会社は非臨床試験の結果を基に、(独)医薬品医療機器総合機構(PMDA)※5へ治験申請を出します(シーズC)。治験の第1相試験では、人に対する薬の安全性を確認し、第2相試験では効果のある容量・用法を検討します。第3相試験では通常、ランダム化(無作為抽出)二重盲検比較試験といわれる客観的に効能を調べる方法の試験を行います。
これらの臨床試験は決められた手順・計画と、定期的な監査の下に行わなければなりません(SOP※6,GCP臨床試験※7)。これら基礎研究から始まる一連の研究・開発について、信頼性をもって進めていくには、それぞれの段階で適切な生物統計の科学的裏付けが必要です。また、治験や製造承認申請に向けて開発する場合には、かなり初期の段階から薬事に関する検討や手続きが必要です。そして、基礎研究の成果を開発研究に発展させる橋渡しについても、どの様な非臨床試験を計画するか、どこの病院と連携するかなどに適切な支援が必要となります。
また、人の検体を扱ったり、人を直接研究対象としたりする場合には、「ヒトゲノム・遺伝子解析研究に関する指針」、「臨床研究に関する倫理指針」をはじめとする多くの指針、規制、法令の遵守を考慮した倫理的観点からの検討・対応が求められます。さらに、製薬等の実現に向けては、開発した知的財産を研究進展の段階ごとに特許化し、より強い特許にする必要性が生じる場合もあります。
特許については、知的財産活用センターが主体となり支援を行いますが、連携推進室も協力していきます。
連携推進室は、基礎研究から実用化への幅広い支援活動を、必要に応じて外部からの専門助言を得ながら行っていきます。
- ・生物統計相談:
- 基礎研究、および実用化での各段階に必要な生物統計の個別相談を行うとともに、研究者に必要な生物統計講座を連続して開催します。そのほか、サンプルの集め方・数量、解析手法、論文での統計に関する文章の書き方、レフェリーのコメントへの対応等など、統計に関してのさまざまなご相談を常時受けています。
- ・薬事相談:
- 将来治験を行い、製造承認申請ヘ進んでいくためには薬事規制に対してどの様に対処すべきなのか、PMDAの薬事戦略相談への対応などを、薬事専門家とともに支援します。PMDAの事前相談等への同行も支援します。しかし、その後の臨床試験・製造承認に進むためには製薬会社との連携が必要です。
- ・橋渡し研究相談:
- 知財と医薬品開発に経験の深い専門家とともに、各プロジェクト研究の基礎研究の中にあるシーズ(実用化への種)を掘り起こすために、研究ヒアリング相談を行います。そして開発研究へ発展させる橋渡し相談を行います。また、人を直接の対象とする臨床研究は、通常は病院でしか行うことはできませんので、その臨床研究が実施可能な病院との共同研究を支援をします。
- ・人を対象とする研究支援:
- 人を対象とする研究の倫理に関する講習会を開催し、インフォームドコンセント、被験者の安全措置、個人情報管理とプライバシー保護などについての研修を行います。倫理審査に関する委員会を主管するとともに、ヒト検体授受の把握と管理に関する支援を行います。
- ・人材育成と教育:
- 上記の活動に関連するセミナーを開催し、医学研職員や都立病院医師等の教育に努めるとともに、府中メディカルキャンパス、松沢病院、駒込病院との間でさらに研究交流が進むように、共同セミナーの開催等を支援します。
現在医学研では、以下のように、治験に進んだ臨床研究(シーズC)が行われています。
- ①難治性統合失調症に対するピリドキサミンによる治療法開発:
- 松沢病院と糸川研究員との共同研究で、医師主導型治験第2相試験から企業治験第3相試験(平成27年開始予定)へと進んでいます。
- ②C型肝炎ウィルスに起因する肝硬変に対する治療薬の開発:
- 駒込病院と小原研究員との共同研究で、医師主導型治験第1相試験の平成26年開始することになりました。
- ③尿中ジアセチルスペルミンによる大腸癌診断薬の開発:
- 駒込病院と平松研究員グループとの共同研究で、企業治験を終了し製造承認を目指しています。
病院等連携研究センターでは、これらの臨床研究をさらに支援していくとともに、医学研の多くの優れた基礎研究の中から実用化へ進む研究を一つでも多く見いだし、強力に支援していきたいと思います。
※略語説明
- ※1 R&D:
- Research and Development
- ※2 GLP:
- Good Laboratory Practice
- ※3 POC:
- Proof of Concept 薬剤・機器の有効性・価値の証明
- ※4 GMP:
- Good manufacturing Practice
- ※5 PMDA:
- Pharmaceuticals and Medical Devices Agency, Japan
- ※6 SOP:
- Standards of Procedures 業務標準手順書
- ※7 GCP:
- Good Clinical Practice
- ※8 TR:
- Translational Research 橋渡し研究

