- 2024年2〜3月にかけて研修生(阿知波-東京大学大学院、森岡-新潟大学大学院)の修士論文発表がそれぞれの大学で無事終わり修士号を取得しました。(写真)
森岡の送別会をしました。(写真) - 2024年3月16日 日本動物学会関東支部第76回大会で優秀発表賞を研修生の片山が受賞しました。(写真)
- 2024年3月13日 桜蔭高等学校の生徒たちが研究室の見学に訪れました。実験の様子などを観察し、研究に興味を持ってくれました。大学院生との交流も喜んでくれました。(写真)
- 2024年3月11日 所内研究発表会第3部会で優秀発表者賞を研修生の森岡が受賞しました。
- 2024年3月8〜9日 第17回神経発生討論会で研修生の杉田と和田が発表し、Young Investigator Awardを和田が受賞しました。
- 2024年2月21日 第13回日本マーモセット研究会で研究員の守屋がポスター発表をしました。
- 2024年2月17日 生化学若い研究者の会 近畿支部・中四国支部共催の冬のセミナーで研修生の杉田が口頭発表を行い、最優秀発表賞を受賞しました。
- 2024年2月16〜17日 生理研研究会:胎児脳発達研究会2024を丸山リーダーが主催しました。松村研究員が口頭発表、研修生の片山がポスター発表を行いました。(写真)
- 2024年1月10〜12日 AMEDの領域班会議が品川で行われ、丸山リーダーが口頭発表、研究員の畠中、松村がポスター発表を行いました。
- 2023年12月14〜15日 第38回熊本医学・生物科学国際シンポジウムで丸山リーダーが口頭発表を、松村研究員がポスター発表を行いました。
- 2023年12月19日 南多摩中等教育学校の生徒たちが研究室の見学に訪れ、興味を持ってくれました。(写真)
- 2023年12月6〜8日 第46回日本分子生物学会年会で研究員の隈元が口頭発表し、研修生の宋がポスター発表を行いました。
- 2023年12月2日 鳥類内分泌研究会で研究員の隈元、研修生の和田、片山がポスター発表をし、若手研究奨励賞を和田が受賞しました。
- 2023年11月11〜15日 Neuroscience 2023で丸山リーダーは招待口頭発表、研修生の森岡はポスター発表を行いました。(写真)
- 2023年11月12日 第一回細胞生物コロキウム・口頭発表部門において、ベストプレゼンター賞(修士の部)を研修生の杉田が受賞しました。
- 2023年8月1日〜4日 仙台で日本神経科学大会に丸山リーダーと研究員の隈元、守屋、松村、研修生の片山、杉田、和田、野口が参加し、野口がジュニア研究者ポスター賞を受賞しました。(写真)
- 2023年7月25日 新潟大学大学院医歯学総合研究科から協和会医学研究助成金を研修生の森岡が受賞しました。
- 2023年6月26日 イギリスのオックスフォード大学でシンポジウムをやり丸山リーダーが発表しました。(写真)
- 2023年5月26日 小金井公園でバーベキューパーティをしました。(写真)
- 2023年6月21日〜23日 スペインのBurgosで行われる国際会議Cortical Evolution 2023に丸山リーダーと隈元研究員、研修生の和田が参加し、丸山リーダーは招待講演、隈元と和田はポスター発表を行いました。
- 2023年5月12日〜13日にAMED-CREST丸山班の班会義を医学研会議室で行いました。
- 2022年4月1日 研究室に新しいメンバーが加わりました。研究補助員:山田芹華(お茶の水女子大4年)
- 2023年3月15日〜17日 京都大学で行われる新学術領域研究「発生時計と場の連携」2023_国際シンポジウム「International Symposium on Neural Development and Diseases」に丸山リーダーと隈元研究員が参加し、丸山リーダーは招待講演を行いました。
- 2023年3月10日〜11日 早稲田大学で行われる第16回神経発生討論会に、研究員の松村、研修生の杉田、野村、和田が発表、丸山リーダー、隈元、守屋が参加しました。
- 2023年3月9日 京都府立医科大学 生物学教室の野村真准教授を招いて、都医学研セミナーを行いました。(写真)
- 2023年3月7日 所内研究発表会第3部会で優秀ポスター賞を研修生の和田が受賞しました。(写真)
- 2023年1-2月にかけて、研修生(杉田-東京理科大、片山-早稲田大、野村-北里大、宋・尾崎-日大、)の卒業論文発表が、それぞれの大学で無事終わりました。
- 2023年1月19日〜20日 新学術ゲノム支援事業拡大班会議がみなとみらい(横浜)で行われ、丸山リーダー、隈元研究員が発表、研究員の守屋、松村、研修生の阿知波が参加しました。
- 2022年10月現在、大学院生絶賛募集中です!
- 2022年12月22日〜24日 AMEDの領域班会議が品川で行われ、丸山リーダーが参加・発表しました。また、AMED研究員の松村、研修生の阿知波、杉田、野村、野口がポスター発表をしました。
- 2022年11月 幕張で行われる日本分子生物学会年会に、研修生で学部4年の杉田、片山、学部2年の野口友理佳が参加し、ポスター発表をしました。
- 2022年10月1日 非常勤研究員として畠中由美子先生が大阪大より着任されました。
- 2022年9月 今年大学院入試を受けた4年生の大学院への進学が決まりました。来年度より、杉田祐輔>早稲田大、片山涼香>早稲田大、野村遥>お茶の水女子大、宋祥赫>東京都立大、和田京介>新潟大、の所属になり引き続き当ラボで研究を進めます。おめでとう。
- 2022年7月21日〜27日 当研究室で夏のセミナーを行いました。都内外より3名の参加者に参加いただき、実験技術を学ばれました(写真:夏のセミナー)。
- 2022年7月 沖縄で開催される国際会議Neuro2022において、丸山リーダーがサブプレートに関するシンポジウムを隈元研究員が脳進化発生に関するシンポジウムを企画しました。また守屋研究員と学部2年の野口友理佳がポスター発表を行いました(写真:Neuro2022-3枚)。
- 2022年7月 研究補助員として佐藤香光乃(日大2年)さんが加わりました。
- 2022年6月27日 イギリスよりZoltan Molnar博士、ドイツよりHeiko Luhmann博士が来日し、医学研セミナーを行っていただきました(写真:医学研で)。
- 2022年6月 事務担当秘書として牧野由希子さんが加わりました。
- 2022年5月31日 丸山リーダーが、イタリア・シチリア島で開催された国際会議「Cortical Development Meeting 2022」(イタリアシチリア島) にて招待講演を行いました。また、修士1年の阿知波ひとみが同学会でポスター発表を行いました。
- 2022年4月1日 研究室に新しいメンバーが加わりました。研究員:松村泰広、研修生:森岡歩夢(新潟大学修士1年)、野村遥(北里大学4年)、杉田祐輔(東京理科大4年)、尾崎茉由(日本大学4年)、片山涼香(早稲田大学4年)。研究補助員:Zi chao Ngiam(早稲田大学博士2年)、白坂みさの(早稲田大学博士1年)
- 2022年3月18日 隈元研究員、丸山リーダーの神経細胞標識に関する英文総説が、Frontiers in Neuroscienceに受理されました。ここをクリック
脳神経系を構成する精緻な神経回路は、
どのようなメカニズムで形成されるのか?
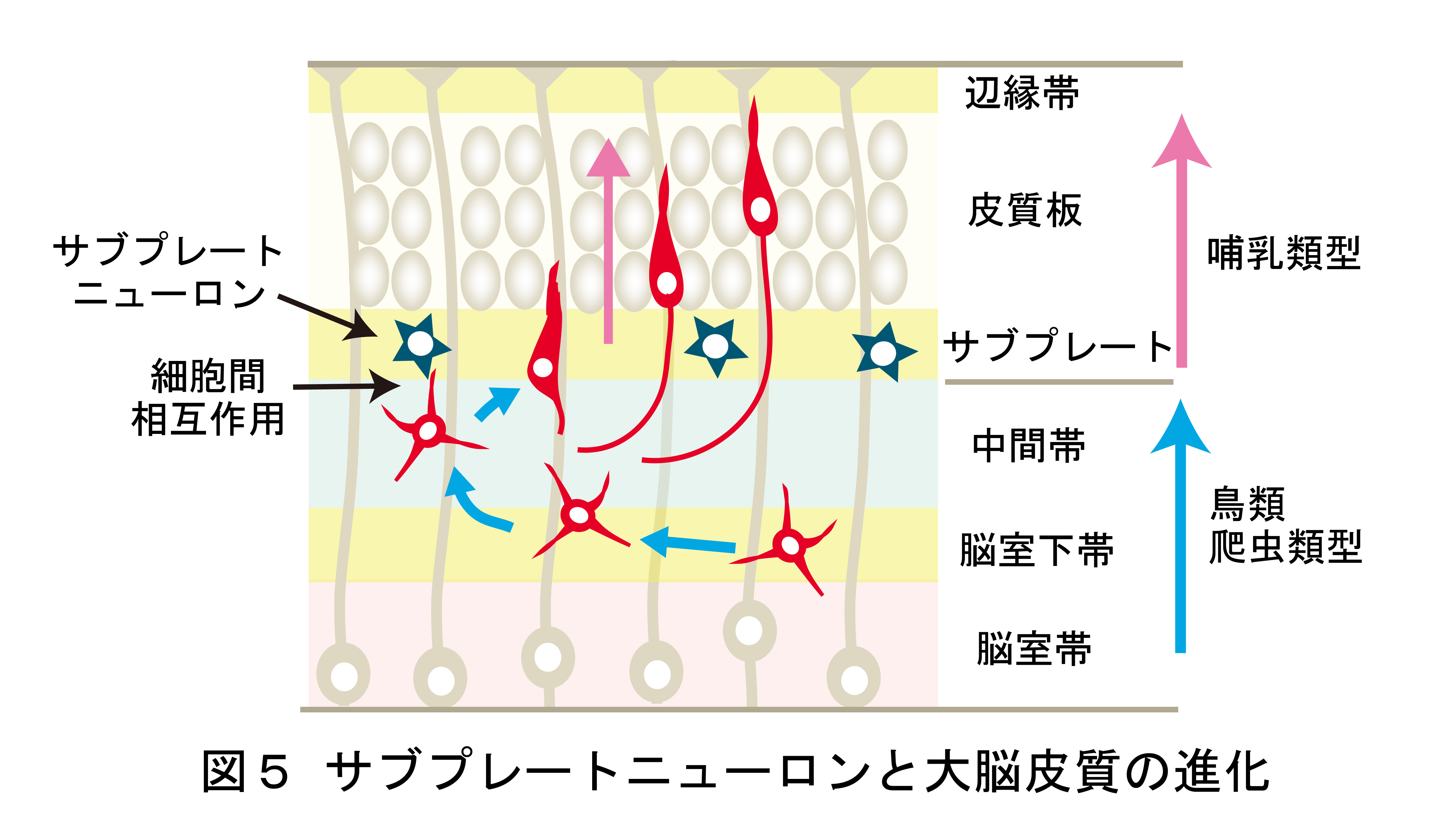
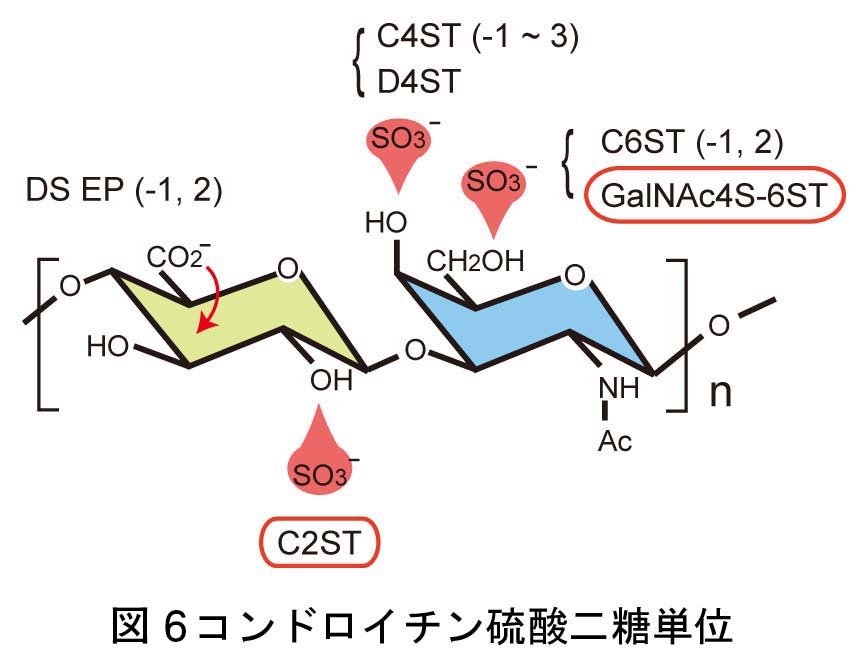
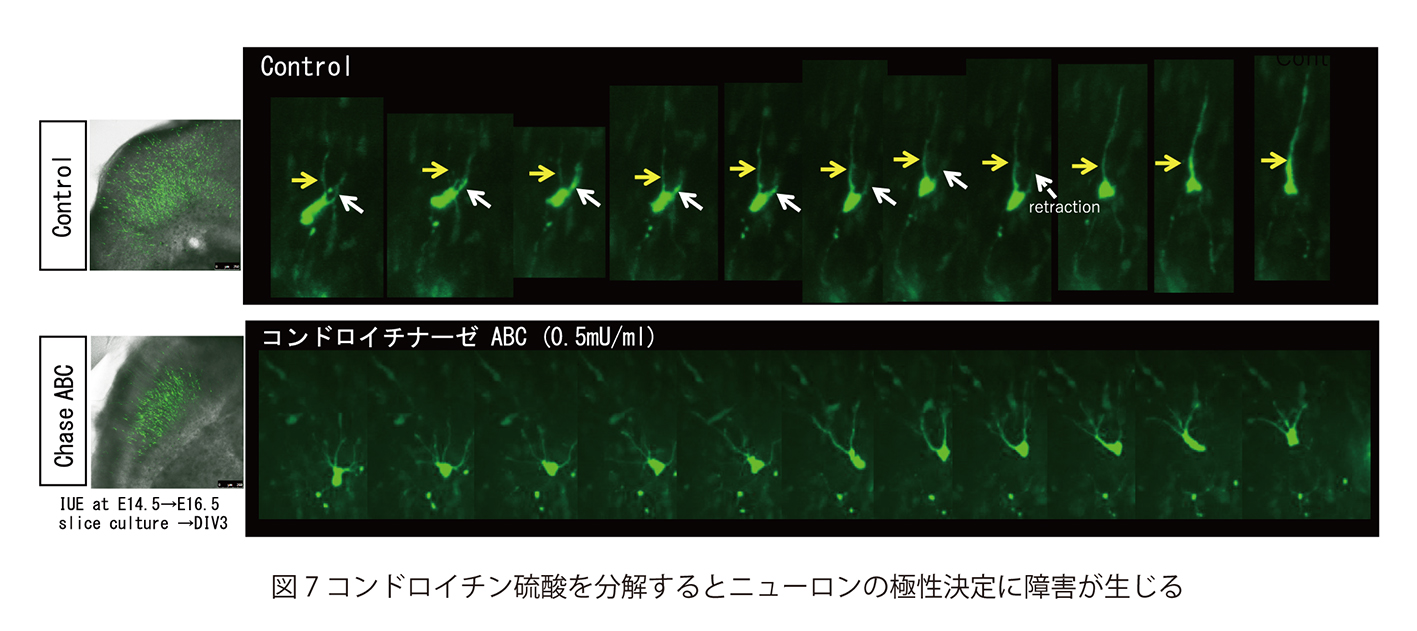
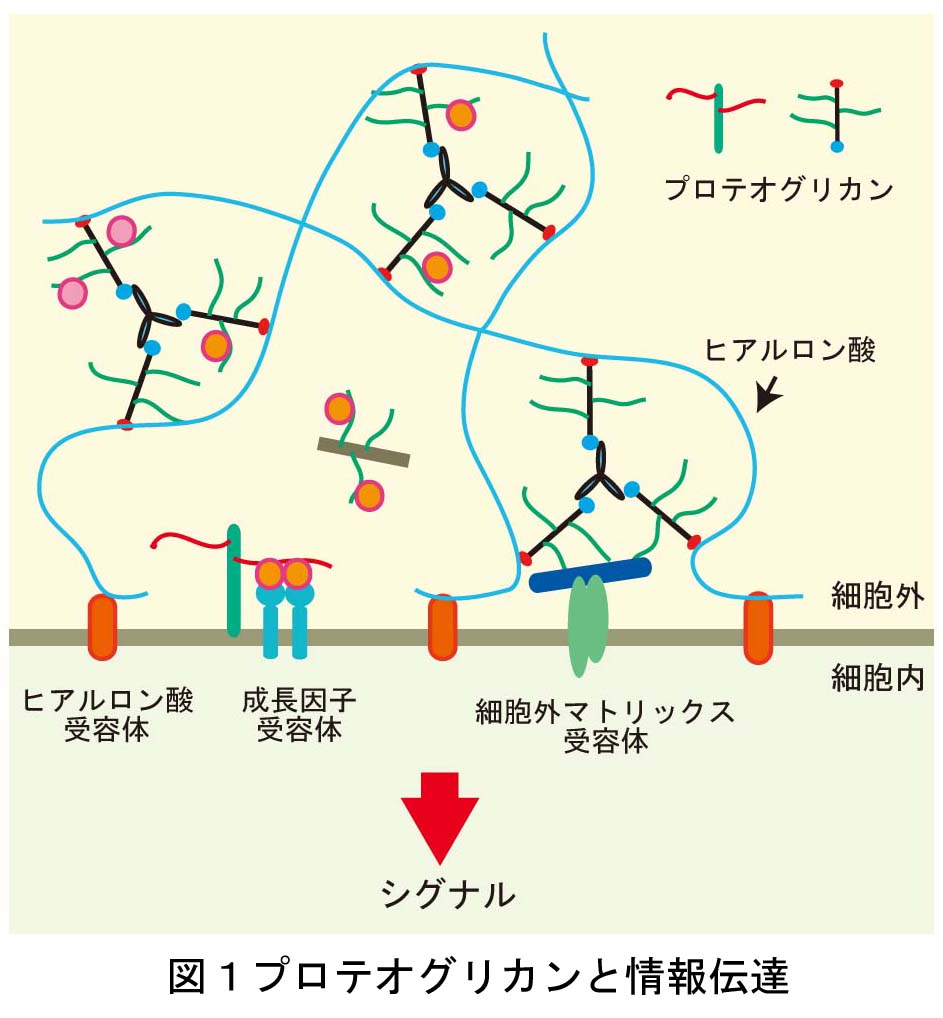
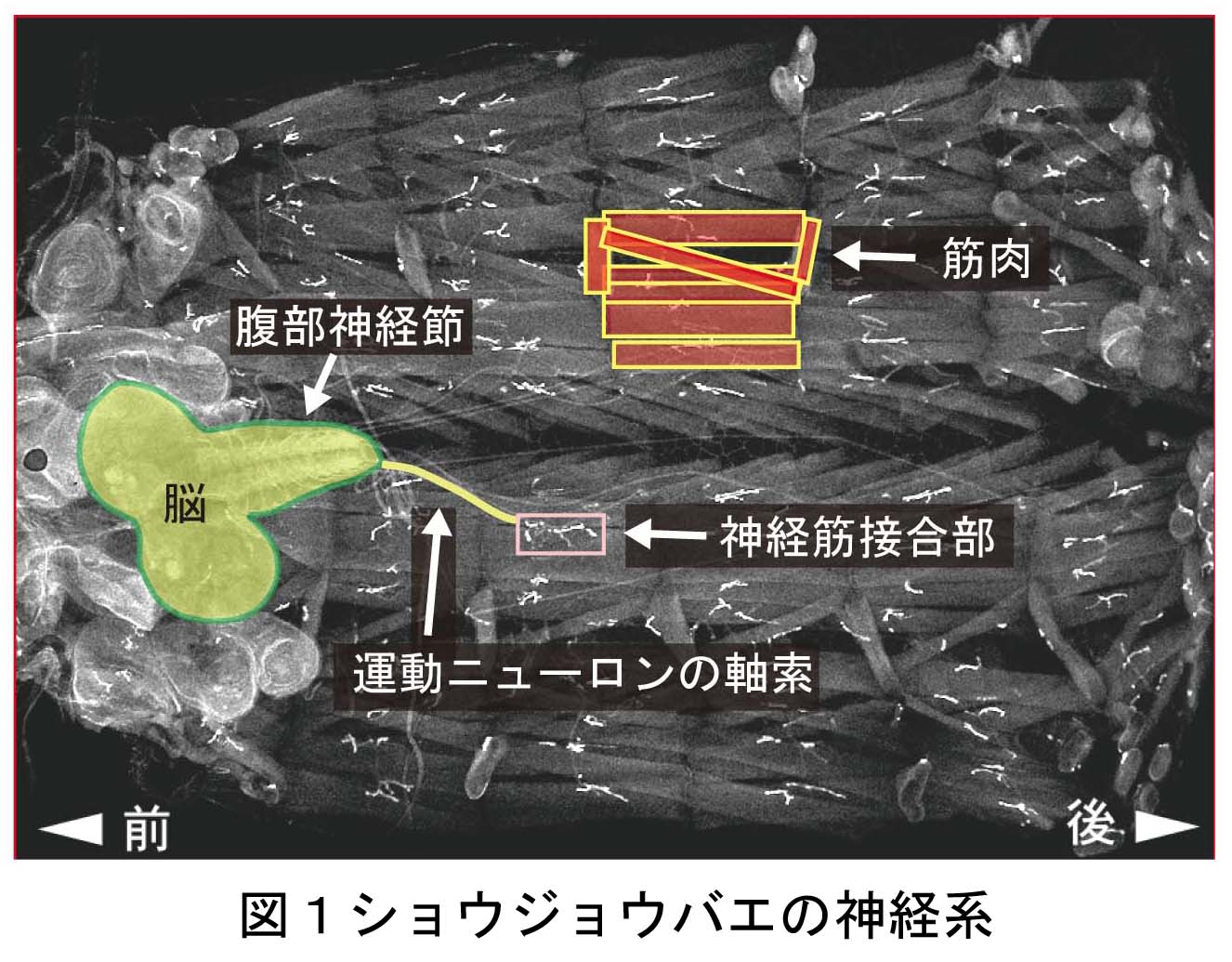
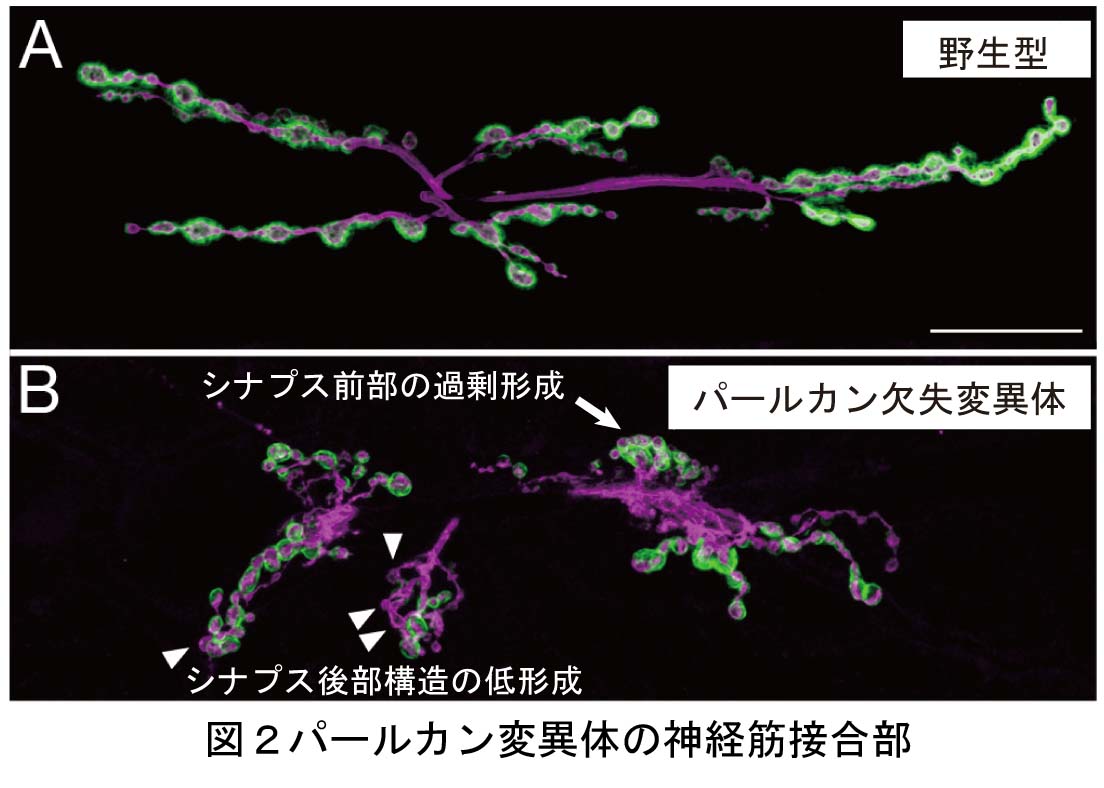
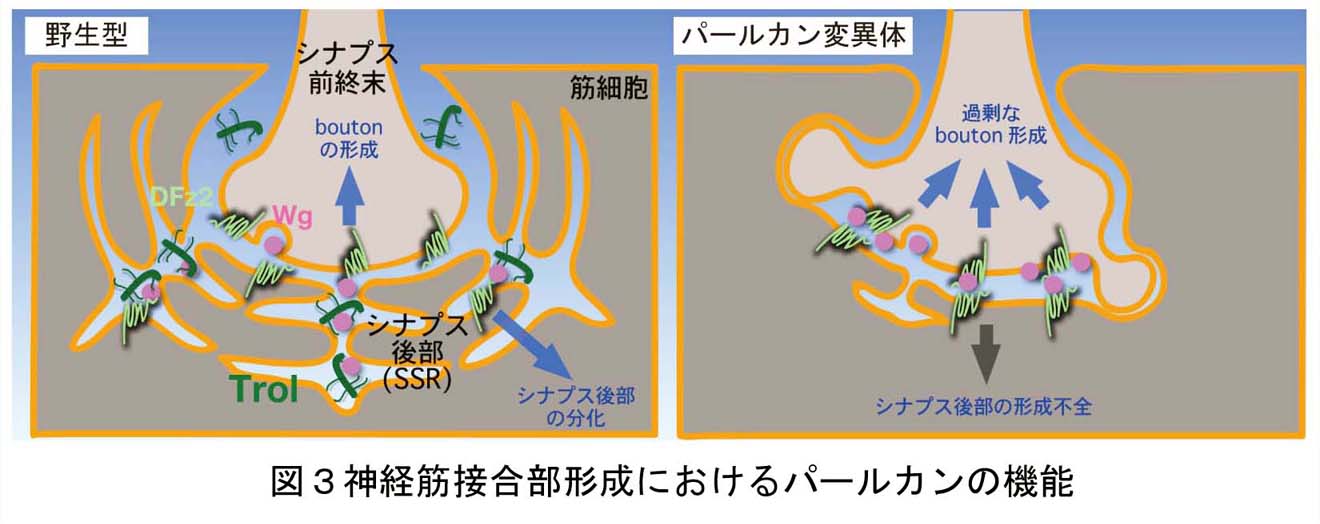
これは、今なお新たな課題が次々に立ち現われてくる深い問題です。神経回路形成は、複雑かつ多様な細胞-細胞間、及び細胞-細胞外マトリックス間の相互作用の下に進行します。本プロジェクトでは、マウス大脳皮質及びショウジョウバエ神経筋接合部をモデルに、このような相互作用の分子メカニズムを解明することを目指しています。