研究概要
プロジェクトの目的
本プロジェクトは、ヒト感覚器疾患の発症機構の解明および有効な予防法を開発するため、ヒト疾患モデルマウスから順遺伝学的アプローチによる疾患発症に関与する遺伝子(群)の同定を最大の目的として研究を行っている。マウスはヒト疾患の原因解明のための最も有用なモデル動物であり、特に我々がこれまで行ってきた順・逆遺伝学的解析は、疾患の原因解明にとって極めて強力なアプローチとなっており、マウスにおける先行研究がヒト疾患の発症原因遺伝子の同定へと直結した例は極めて多い。さらに外部環境の影響を多大に受ける感覚器疾患においては、飼育室内環境を容易に調節しうるマウスの実験系は、より精密な疾患研究を可能にする。これらの利点を最大限に生かし、我々は感覚器疾患の中でも聴覚障害および視覚障害に焦点を絞り、順遺伝学およびゲノム科学の解析手段を併用して、ヒト疾患モデルの病態発症に関与する遺伝子(群)の同定することをプロジェクトの目的として研究に取り組んでいる。さらに、これらのモデルに核およびミトコンドリアゲノムの遺伝的背景が異なる様々な近交系との交配によって、病態の重篤度に対する変化を導き出し、それら病態修飾に関与する遺伝子の同定も目指している。
研究方法
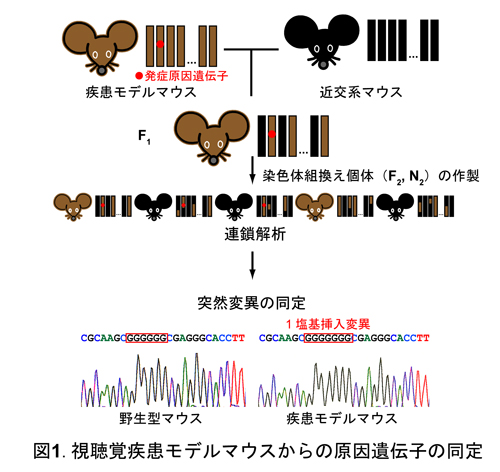
聴覚障害についてそれぞれの疾患のモデルマウスから順遺伝学に基づき主要原因遺伝子または修飾遺伝子を同定し、これを出発点としてヒト疾患発症に関与する遺伝子群を同定するものである。図1には疾患原因遺伝子の同定への実験手順を示しており、その手法は系統間交配群を作製し、これらの表現型と遺伝子型の連鎖解析によって明らかとした突然変異が存在する染色体上の位置情報を出発点とし、原因遺伝子を同定するポジショナルクローニングに順じて解析を実施している。また、我々は主働原因遺伝子の効果を修飾する遺伝子群同定を同定するため、ヒト疾患モデルマウスと日本産野生マウス由来の近交系を含む様々なマウス系統との交配後、主要発症原因遺伝子の同定時と同様に順遺伝学に基づく解析に、網羅的トランスクリプトーム解析を加えることによって、表現型と遺伝子型または遺伝子発現レベルとの相関解析を行うことにより疾患発症に関連する遺伝子の同定を目指している。さらに、同定した視聴覚疾患発症関連遺伝子群は分子生物学的な解析を行うとともに、逆遺伝学の手法によって同定した疾患関連遺伝子の機能を評価し、新たな視聴覚障害のモデルマウスを樹立する。
主要研究テーマ
聴覚障害モデルマウスからの発症原因遺伝子の同定および機能解析
①先天性難聴発症モデルマウスの発症原因遺伝子の同定と機能解析
現在我々は内耳有毛細胞の感覚毛(stereocilia)形成異常を示す3種先天性難聴モデルマウス、NOD/Shi (NOD), Rinshoken shaker/waltzer (rsv) およびKumamoto shaker/waltzer (ksv) からポジショナルクローニングの手法に従って原因遺伝子の同定を行っている。
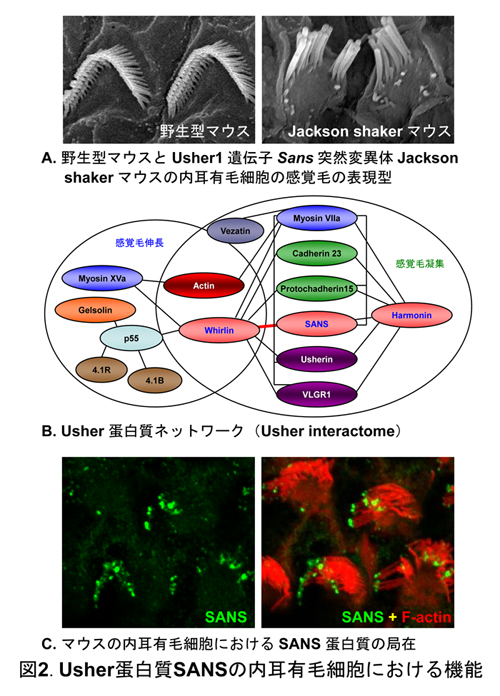
また、これらの新規難聴モデルマウスに加え、我々は数種の感覚毛異常の先天 性難聴モデルマウスの原因遺伝子を同定している(図2A)。これらは主にヒト Usher症候群の原因遺伝子がコードする蛋白質ネットワークのメンバーであり (図2B)、このネットワークが感覚毛形成・維持に重要な役割をもつことが明ら かになりつつある。そこで我々はこれらUsher蛋白質の発現を調査し(図3B)、 さらにこのネットワークの新たなメンバーのスクリーニングを行っている。
②近交系マウスをモデルとした加齢性難聴原因遺伝子の同定
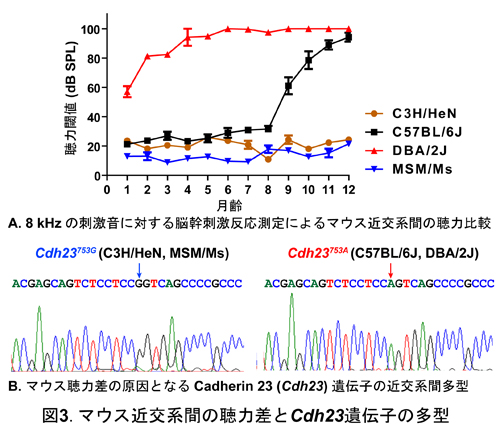
マウスには400種を超える近交系が樹立されており、これらの近交系間は多様な聴力差が認められる。図3Aには我々が数種の近交系マウスの聴力測定を経時的に行った結果を示しており、C3H/HeNおよびMSM/Ms系統は生後12ヶ月齢まで安定した聴力を示すが、C57BL/6J系統は加齢性難聴を、DBA/2J は早期の聴力低下を示す。この聴力差の主要な原因はカドヘリン23の遺伝子多型によることが明らかとなっているが(図3B)、それぞれの系統には複数の感受性遺伝子が存在し、この感受性遺伝子の多型によって難聴発症時期が修飾される。そこで我々はこのような系統間の難聴発症時期を修飾する遺伝子の探索を行っている。
発表論文の概要
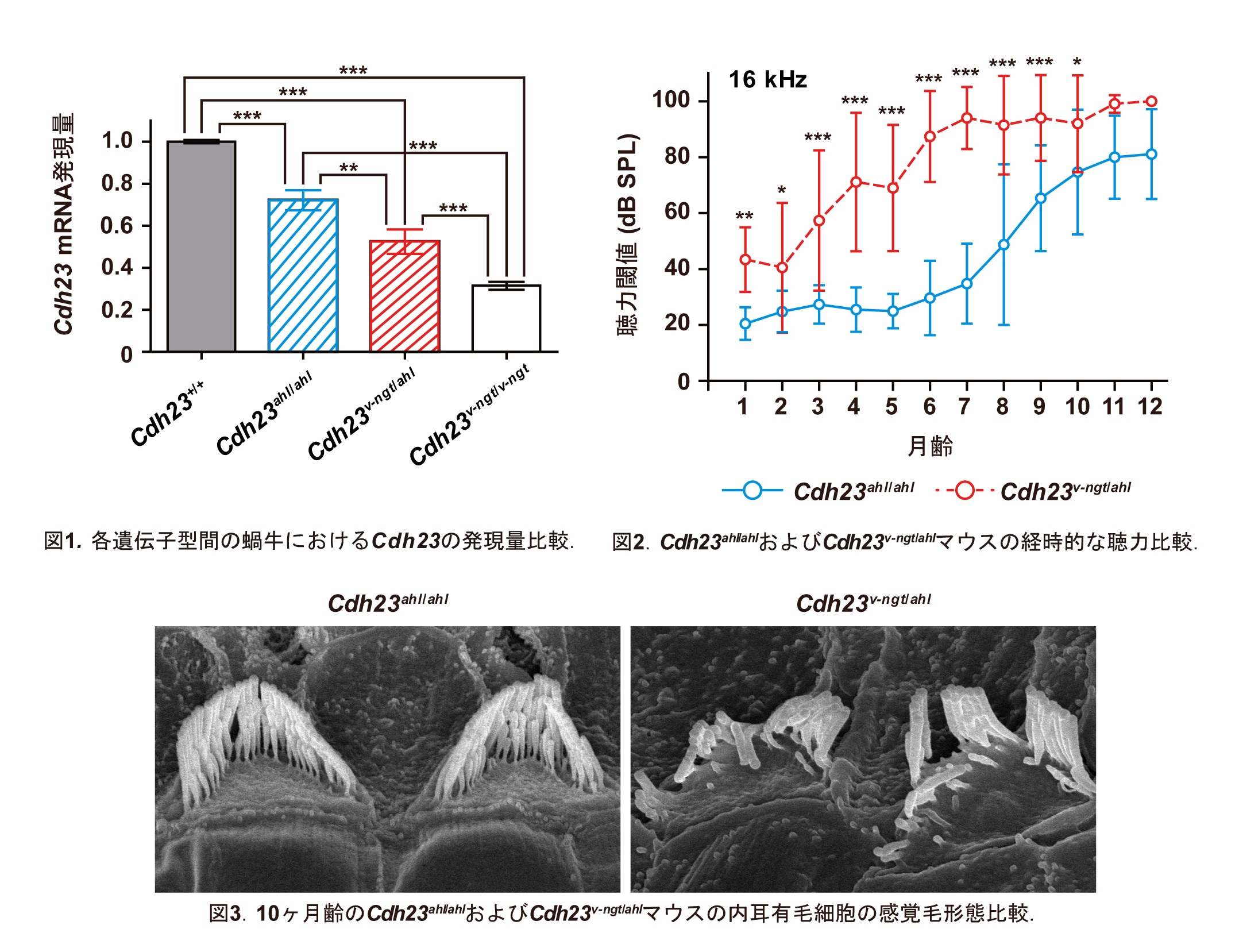
マウスにおけるカドヘリン23の機能欠損Cdh23v-ngtアレルとハイポモルフCdh23ahlアレルのヘテロ接合体は早発性・加齢性難聴を発症する
waltzer niigata (Cdh23v-ngt) マウスは、Cadherin 23 (Cdh23) の突然変異体であり、内耳有毛細胞の感覚毛の形成不全による先天性難聴および平衡感覚異常を発症します。一方、多くの近交系マウスが保有するハイポモルフCdh23ahlアレルは、マウス加齢性難聴の発症に関与します。本研究では、機能欠損Cdh23v-ngtアレルとハイポモルフCdh23ahlアレルの複合ヘテロ接合体 (Cdh23v-ngt/ahl) を作製し、長期的な聴覚の表現型解析および遺伝子発現解析を行うことで、Cdh23の加齢性難聴へ与える影響を検証しました。その結果、Cdh23v-ngt/ahlヘテロ接合体はCdh23ahl/ahlホモ接合体に比べてCdh23の発現量が低下し、早期の聴力低下が認められました。さらに、Cdh23v-ngt/ahlヘテロ接合体の聴力低下は加齢に伴い進行し、感覚毛の崩壊に起因することも明らかとなりました。内耳有毛細胞においてCDH23は、感覚毛間をつなぐチップリンクに局在しており、Cdh23遺伝子の発現量が減少することで、感覚毛間の「張力(tension)」が緩み、感覚毛が崩壊し、「聴力」の早期低下を引き起こしたと考えられます。これらの結果からCDH23は老化プロセスにおけるチップリンクの維持に必須の蛋白質であることが示唆されます。
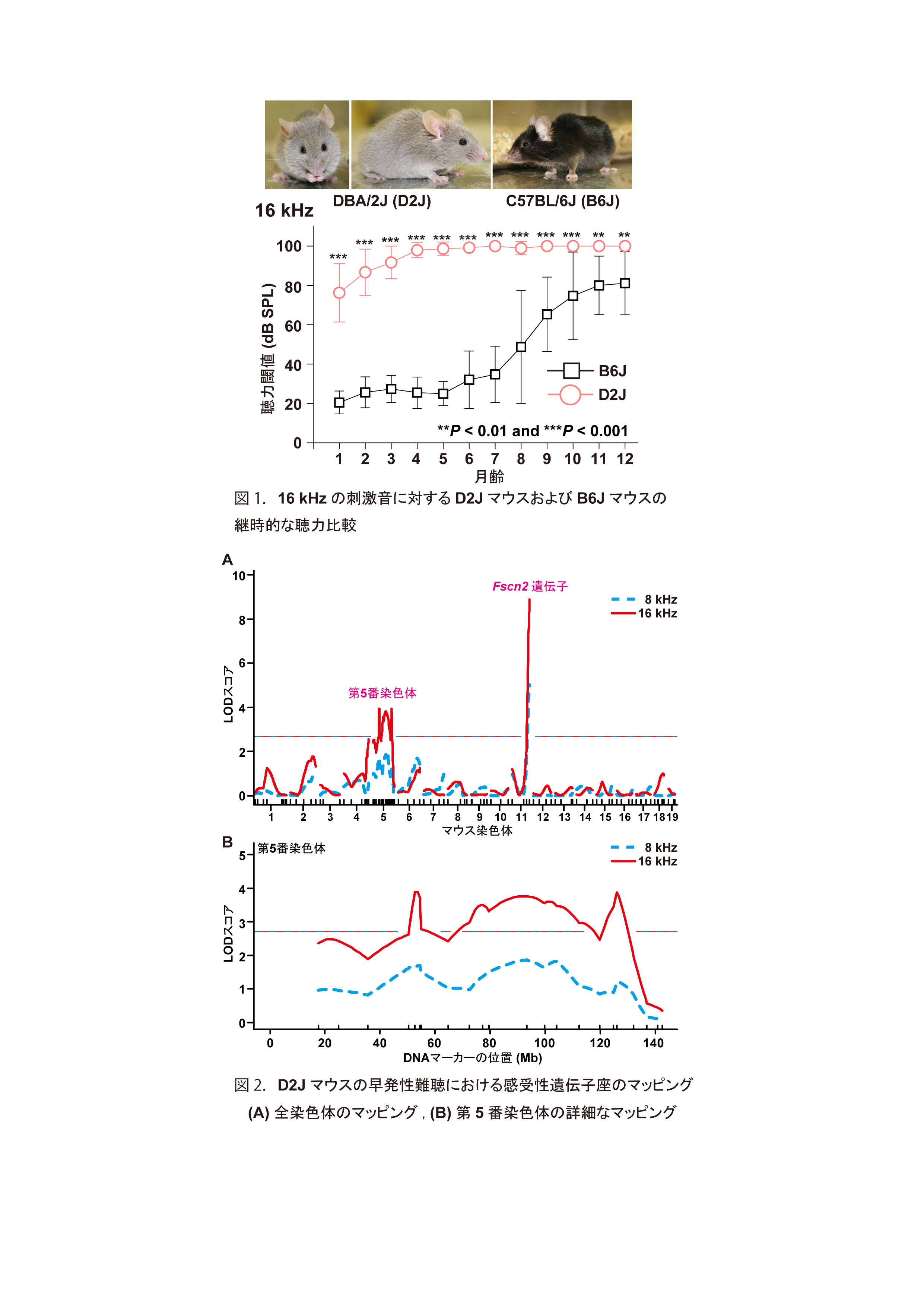
DBA/2Jマウスにおける周波数特異的な聴力に効果をもつ第5番染色体上の感受性遺伝子座。
DBA/2Jマウス系統はヒトの早発性進行性難聴のモデルマウスとして知られ、超音波から低周波数領域にかけて聴力が低下し、重度難聴を発症します(図1)。その早発性難聴の遺伝的な原因としては、cadherin 23遺伝子のahlアレル (Cdh23ahl) およびfascin 2遺伝子のahl8アレル (Fscn2ahl8) の効果が報告されています。今回私たちは、DBA/2Jマウスに遅発性難聴モデルマウスであるC57BL/6Jマウスを交配して作製した戻し交配個体群を用いた遺伝学的解析によって、16 kHzの聴力においてはFscn2ahl8アレルの効果に加え、第5番染色体上の50.3~54.5, 64.6~119.9および119.9~137 Mbの3領域にDBA/2Jマウスの難聴発症に関与する遺伝子座が存在することを明らかにしました(図2)。また、DBA/2Jマウスの超音波周波数である32 kHzの聴力においてはFscn2ahl8アレルの効果は検出されず、さらに、超音波周波数においてはCdh23ahlアレルに加えて優性効果をもつ遺伝子座の存在を示すデータを得られました。従って、DBA/2Jマウスの早発性難聴は、その遺伝的背景に存在する周波数特異的な聴力機能に作用する遺伝子群によって支配されていることが明らかとなり、本論文によって、DBA/2Jマウスのヒト難聴発症のモデル動物としての新たな可能性を示すことが出来ました。
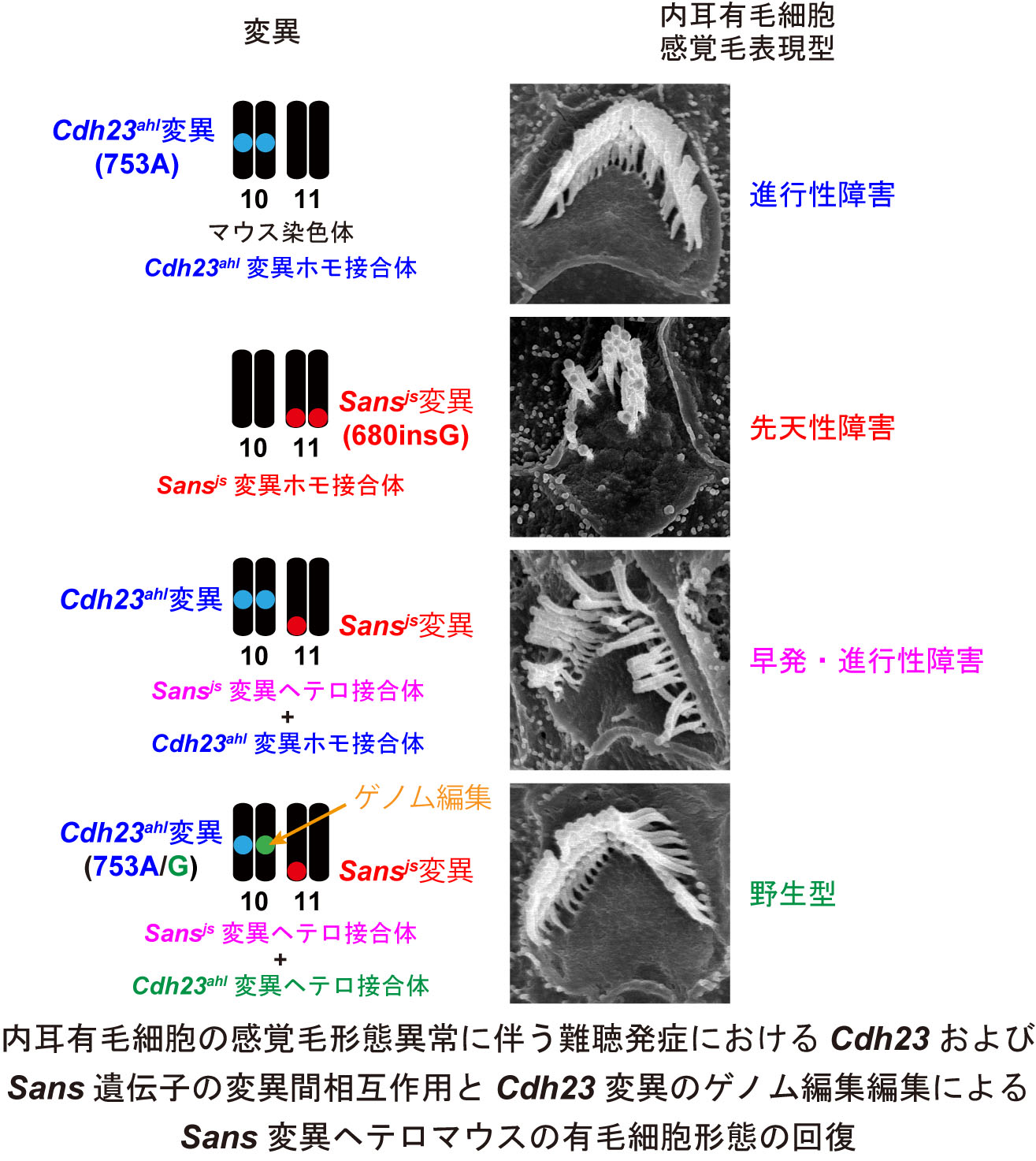
マウスにおけるUsh1g/Sans遺伝子のヘテロ接合変異は早発・進行性難聴の原因であり、その難聴発症はカドヘリン23遺伝子のマウス系統特異的変異の修復によって回復した
難聴は1,000人に1人と高頻度で発症する感覚器疾患です。近年、難聴発症の原因となる変異は多くの患者で発見されていますが、同一の難聴発症原因遺伝子に生じた類似した変異でもその病態が大きく異なることが報告されています。その原因は各個人の「遺伝的背景」、すなわちゲノムの多型の違いが難聴発症原因遺伝子と関連することが昔から推定されていましたが、その証明はなされていませんでした。そこで私たちは難聴モデルマウスを用いてこの現象を検証しました。
私たちは難聴モデルマウスの一系統であり、ヒト難聴の発症原因遺伝子であるSans (Ush1g) 遺伝子変異が劣性ホモの状態で重度難聴を発症するジャクソンシェーカー(js)マウスが、ヘテロ変異でも早発型の優性難聴を発症することを明らかにし、同時にjsマウスの難聴は、交配するマウス系統によってその病態が大きく異なることを見出しました。そこで私たちは順遺伝学的解析を実施し、優性難聴発症に関与する遺伝子座、カドヘリン23(Cdh23)を同定しました。さらに私たちは、Cdh23に存在するマウス間のDNA変異(ahl変異:753A)をCRISPR/Cas9システムを介したゲノム編集によって修復しました。その結果、jsマウスの難聴発症は完全に回復しました。これらの実験結果から、私たちはjsヘテロマウスの早発型進行性難聴の発症が2つの遺伝子に生じた変異の相互作用効果によって成立することを塩基置換レベルで実証することに成功しました。
また、この研究は日本学術振興会科研費の基盤研究B(20300147, 23300160および15H04291:代表・吉川欣亮)および特別研究員奨励費(14J06119:代表・宮坂勇輝)の助成を受け実施しました。
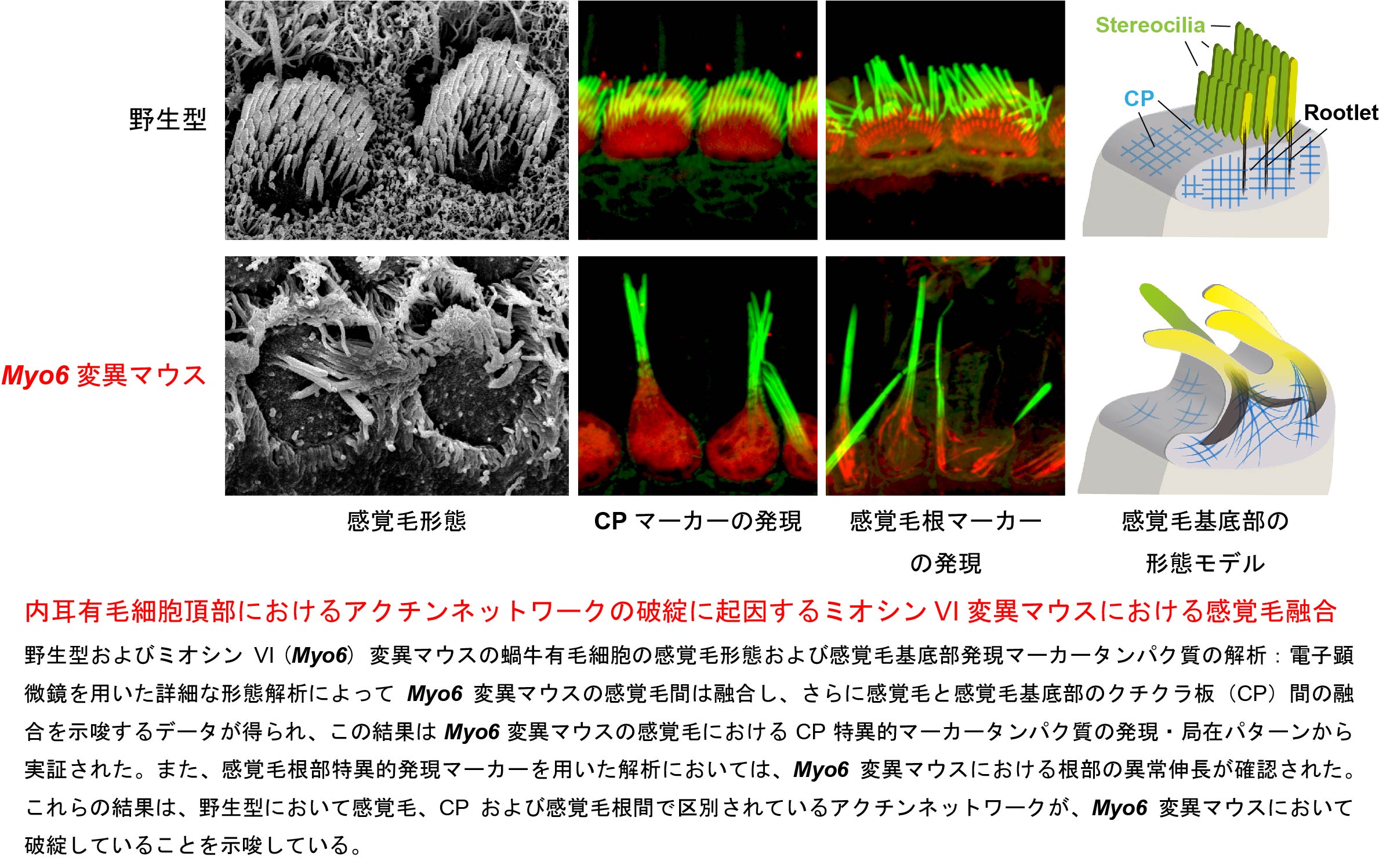
マウスミオシンVIの新規スプライス変異は内耳有毛細胞における頂部領域のアクチンネットワークの破綻を引き起こす
非筋肉性モータータンパクの一種であるミオシン VI遺伝子 (Myo6) はヒトとマウスに共通の難聴原因遺伝子です。私たちは内耳感覚毛の融合に起因した先天性の平衡異常および聴力欠損を発症するKumamoto shaker/waltzer (ksv) マウスを発見し、ポジショナルクローニングによってMyo6に未報告のスプライス変異を同定しました。このマウスの感覚毛融合過程を電子顕微鏡により詳細に観察した結果、感覚毛融合は感覚毛の極性異常、感覚毛束間の融合、有毛細胞頂部のアクチン細胞骨格であるクチクラ板の隆起および陥入による感覚毛-クチクラ板間の融合が起こることを示唆するデータが得られました。また、クチクラ板で特異的に発現するタンパク質を染色した結果、ksvマウスの感覚毛ではこのタンパク質の存在を示唆する強いシグナルが得られ、電子顕微鏡観察のデータから示唆されたデータが実証されました。さらに、私たちはksvマウスの感覚毛を感覚毛の根部で特異的に発現するタンパク質で染色した結果、ksvマウスでは根部が異常に伸長していることを示すデータが得られました。有毛細胞の感覚毛、根部およびクチクラ板はそれぞれが区別されたアクチン繊維構造によって形成されており、Myo6変異によりこれらの区別が破綻し、Myo6変異マウスでは感覚毛が融合するものと推察され、Myo6はこれらの構造の維持に重要な役割をもつことが強く示唆されました。
本研究は日本学術振興会科研費基盤B(JP23300160)、挑戦的萌芽研究(JP15K15625)および若手研究B(JP15K18393)の助成を受け実施しました。
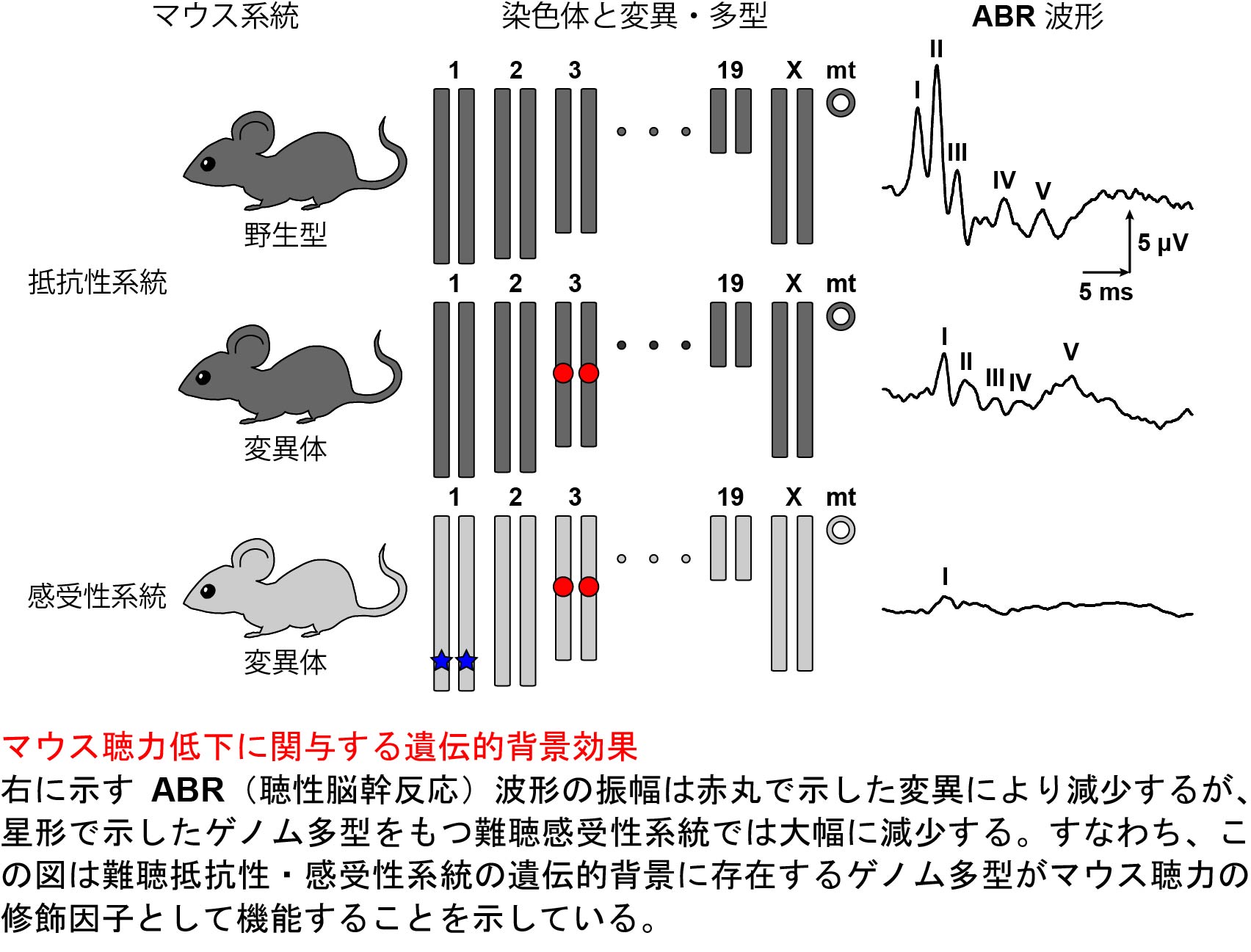
マウスの聴力低下における遺伝的背景の感受性効果
加齢性難聴および騒音性難聴などの後天性難聴の病態は多様であり、その原因の1つは遺伝的背景に潜む病態修飾効果をもつゲノム多型であることが知られています。このような多様性はヒトのモデル動物であるマウスにおいても認められており、多くの研究者がマウスを使って病態修飾効果の研究を進めてきました。私たちは、今回発表した総説論文において、マウスを用いた聴覚の病態を修飾する遺伝的背景効果の研究、特に修飾遺伝子およびゲノム多型の同定のための研究方法および研究例について紹介しています。ご興味のある方は以下のウェブサイトからダウンロードしてください(無料)。
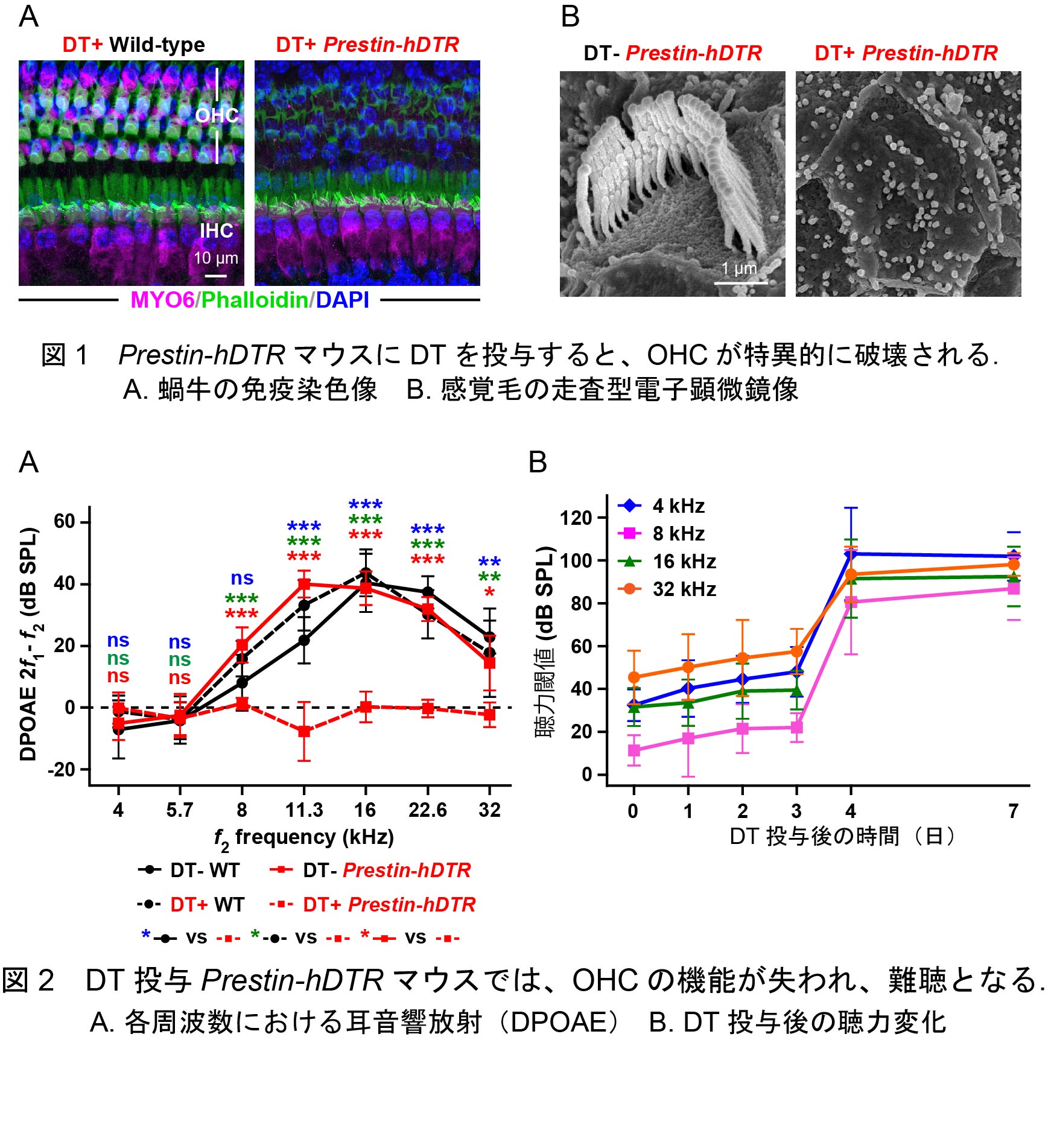
新しい内耳外有毛細胞欠損モデルマウスの開発
内耳外有毛細胞(OHC)は伸縮運動することにより、微弱な音を増大し、逆に強すぎる音は抑制的に伝達するという「聞こえの調節」をしています。ヒトが鋭敏な聴力を得られるのはこのためで、OHCの異常は難聴の発症に直結します。OHCは弱い細胞で、細菌やウイルスの感染、騒音への曝露、アミノグリコシド系抗生剤の投与等によって損傷を受け、また、加齢によってもその数は減少します。高齢者に難聴患者が多いのはそのためですが、根本的な治療法はなく、補聴器や人工内耳の装用により聴力を補わざるを得ません。加齢性難聴は人類で最も多い慢性疾患の一つであり、OHCの機能メカニズムを明らかにすることが難聴の予防や治療法の開発の基礎となると期待されます。そこで私達は、OHCの分子メカニズムを解明するためのツールとして、TRECK法という方法でジフテリア毒素(DT)の投与により任意の時期にOHCを誘導的に破壊することのできるマウスモデル(Prestin-hDTRマウス)を開発しました。
Prestin-hDTRマウスにDTを投与すると、内耳の蝸牛および前庭に存在する他の細胞には影響を与えず、OHCのみが特異的に破壊されました(図1)。OHCが破壊されたマウスは、OHC特有の伸縮運動を反映する歪成分耳音響放射(DPOAE)が消失し、重度の難聴となりました(図2)。OHCを欠失したことにより引き起こされる遺伝子の発現変動をマイクロアレイで網羅的に比較した結果、免疫反応に関連する遺伝子の発現がOHC破壊マウスの蝸牛で増加していることが明らかとなり、OHCの細胞死に対する対応と考えられました。一方、OHC破壊マウスで著しい発現減少が認められる遺伝子には、難聴原因遺伝子や聴覚関連遺伝子の他、聴覚における役割の知られていない遺伝子も含まれていました。これらの結果から、本研究で樹立したPrestin-hDTRマウスはOHCの細胞死に関連する遺伝子の同定に極めて有用なツールとして期待されます。
本研究は日本学術振興会科研費基盤C(JP24500502およびJP15K06818)および基盤B(JP16H04688)、および株式会社ケー・エー・シー創立35周年記念研究助成の助成を受け実施しました。
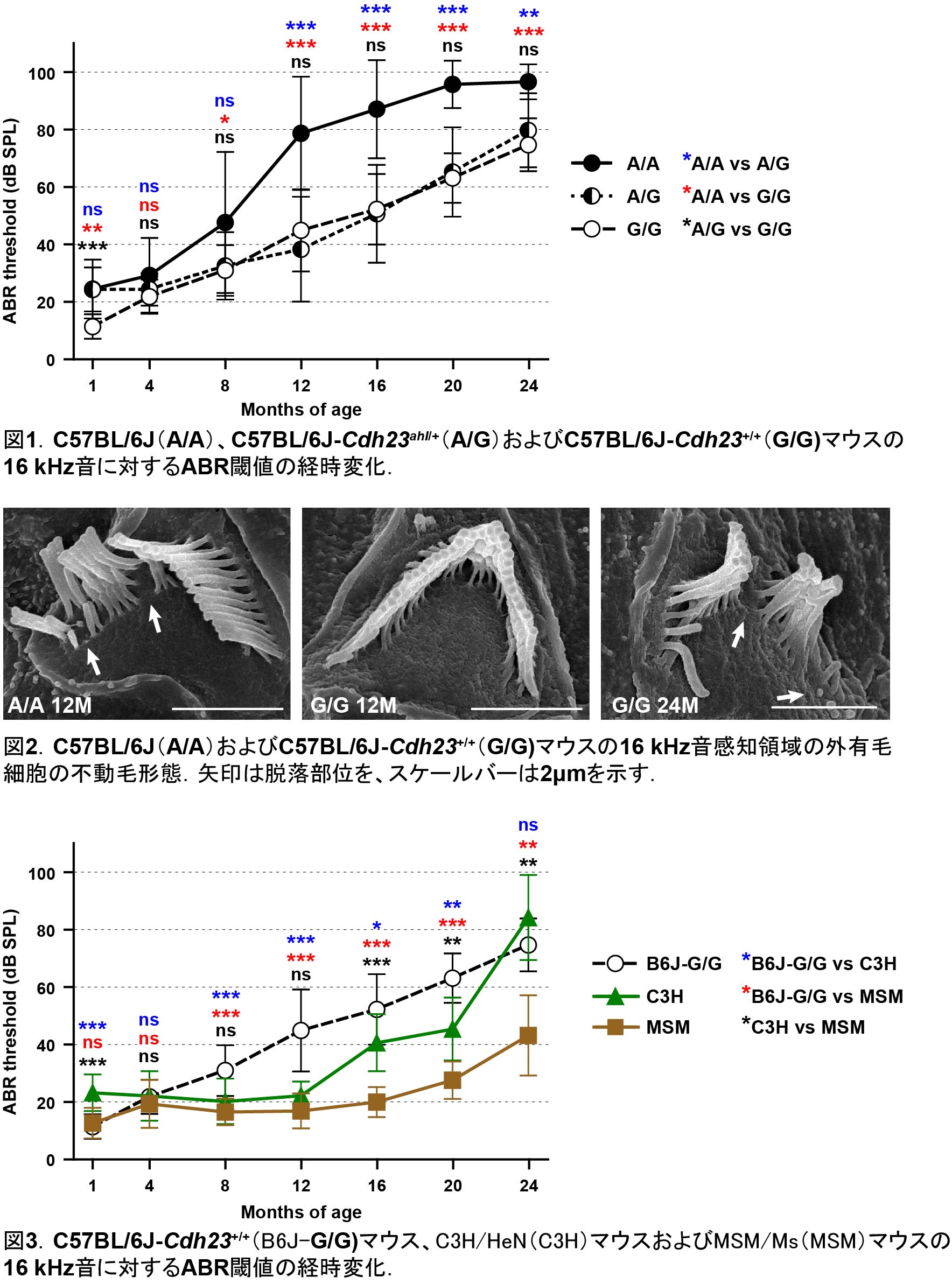
カドヘリン23遺伝子のahlアレルをレスキューしたC57BL/6Jマウスは加齢性難聴の発症が遅延する
C57BL/6Jマウスは、加齢性難聴(ARHL)のモデルとして古くから研究されてきました。C57BL/6JマウスのARHLは、3ヶ月齢で高音域から始まり、10ヶ月齢までに低音域へと進行しますが、その責任アレルはカドヘリン23遺伝子(Cdh23)のahlアレル(c.753A)であることが報告されています。これまでの研究からは、ahlアレルの変異を野生型に修正したc.753A>Gゲノム編集が、C57BL/6JマウスのARHL発症を12ヶ月齢まで抑制できることが明らかとなっています。本研究では、C57BL/6Jマウスとゲノム編集されたC57BL/6J-Cdh23+/+ (c.753G/G)マウスの24ヶ月齢までの聴覚表現型を調査しました。聴力試験の結果、C57BL/6J-Cdh23+/+マウスは14ヶ月齢まで良好な聴力レベルを維持していることがわかりました。しかしながら、その聴覚レベルは徐々に低下し、加齢に伴ってARHLが重篤化することが判明しました。C57BL/6Jマウスの内耳の表現型を調査したところ、ARHLの発症は内耳有毛細胞の不動毛の異常と関連していることが示唆されました。C57BL/6J-Cdh23+/+マウスでは、12ヶ月齢では不動毛の異常は認められませんでしたが、その後は加齢に伴いC57BL/6Jマウスと同様の異常な表現型を示しました。これらの結果から、Cdh23ahlのゲノム編集は、C57BL/6JマウスのARHLを完全には抑制できないことが明らかとなりました。また、C57BL/6J-Cdh23+/+マウスの聴力レベルを、Cdh23+アレルを持つC3H/HeNおよびMSM/Msマウスの聴力レベルと比較したところ、C57BL/6J-Cdh23+/+マウスのARHLの重症度と発症パターンは他のCdh23+/+マウスとは異なっていました。したがって、これらのマウスの遺伝的背景には、他のARHL感受性または抵抗性のアレルが存在することが示唆されました。
本研究は日本学術振興会科研費基盤B(JP23300160およびJP15H04291)および基盤C(JP18K09364)の助成を受け実施しました。
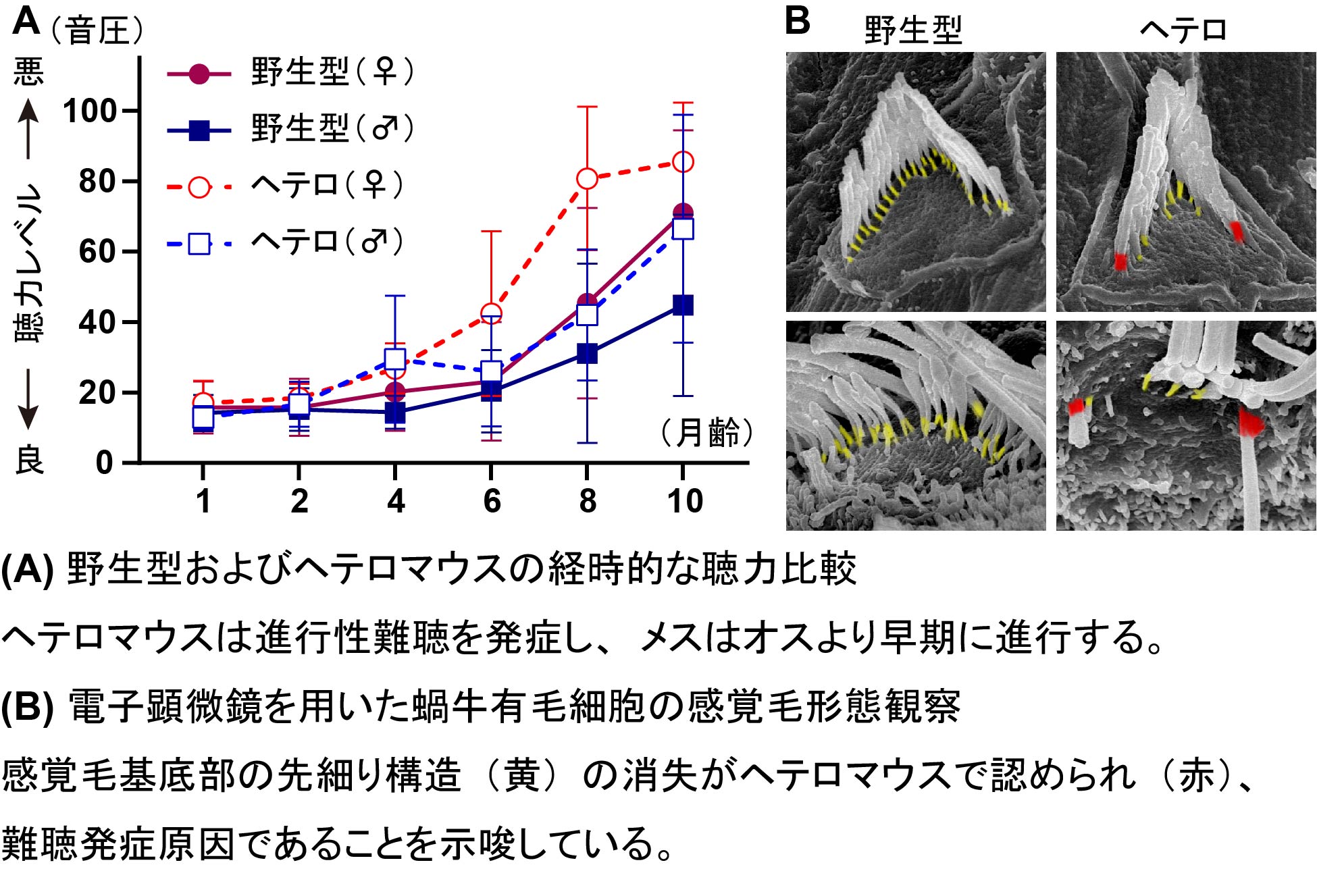
ミオシンVI(MYO6)のハプロ不全はマウスの聴力を低下させる
ヒトにおいて、ミオシンVI(MYO6)のハプロ不全は、言語習得後に進行性難聴を引き起こします。この病態に対するマウスモデルの有用性は未だ不明なままであったため、私達は、新規のMyo6ノックアウト(KO)変異マウスを樹立し、Myo6KOヘテロ接合変異体の聴覚表現型を解析しました。最初に、コントロールのMyo6野生型マウスとヘテロマウスで、聴力レベルを調査するため、聴性脳幹反応と外有毛細胞(OHC)の伸縮運動を反映する歪成分耳音響放射を記録して比較しました。ヘテロマウスにおけるこれらの聴覚表現型は軽度でしたが、進行性難聴は野生型よりも早期に認められました(図A)。ヘテロマウスの感覚毛は、内有毛細胞(IHC)とOHCで感覚毛基底部の先細り構造が消失していました(図B)。へテロ接合体におけるOHCの消失は、野生型マウスよりも早い月齢で認められました。特に、蝸牛の基底領域のOHCはヘテロマウスで減少しました。蝸牛の基部領域のIHCリボンシナプスは、ヘテロマウスで有意に減少しました。したがって、本研究は、MYO6ハプロ不全がマウスの音の「聞こえ」に影響を与えることを実証し、Myo6KO対立遺伝子を持つヘテロマウスが、MYO6ハプロ不全による進行性難聴患者の遺伝子治療および薬物治療のための有用な動物モデルであることを示唆しています。
本研究は日本学術振興会挑戦的萌芽研究(JP15K15625)、若手研究(B)(JP15K18393)および若手研究(JP18K16913)の助成を受け実施しました。
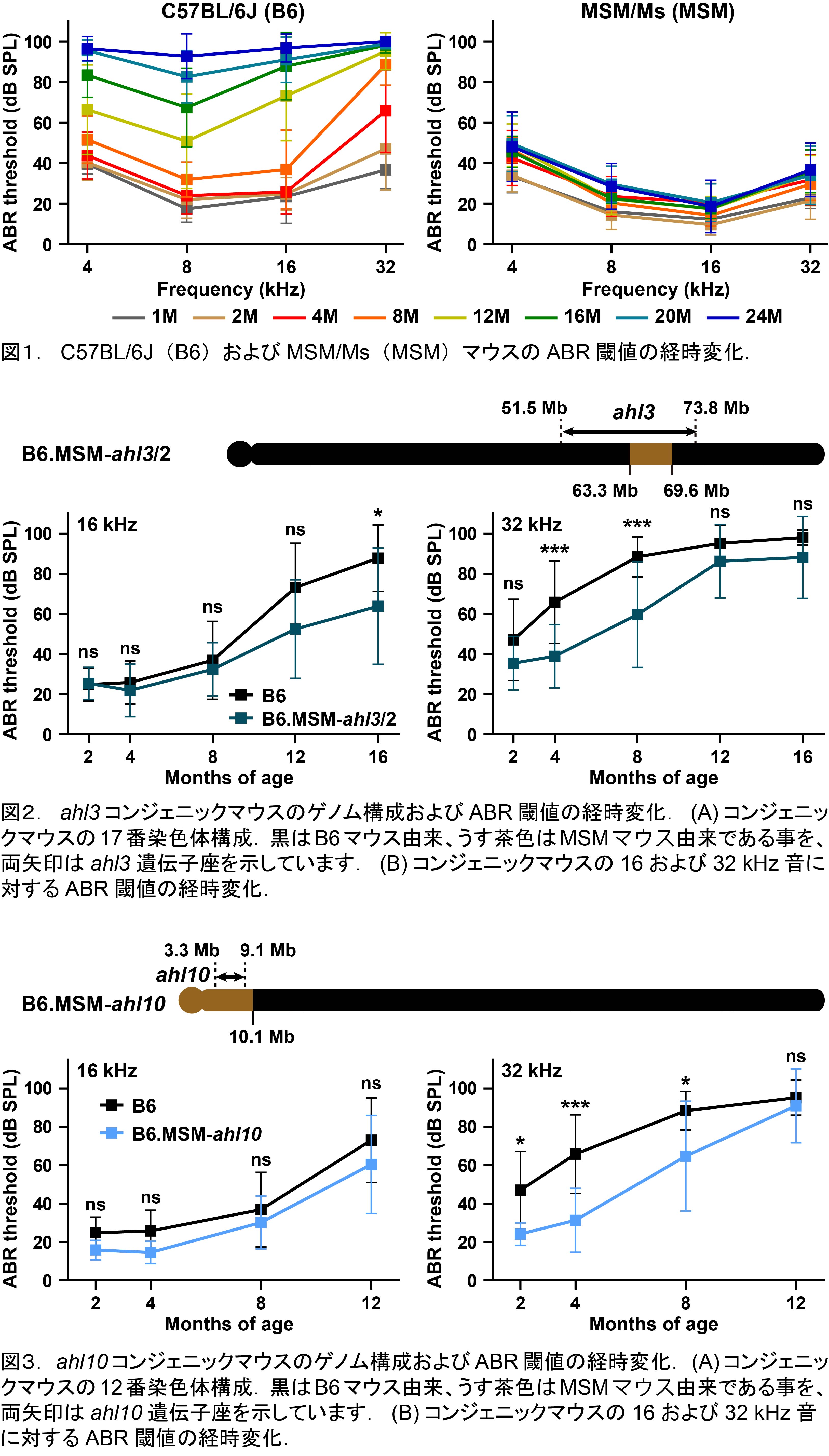
日本産野生マウス由来MSMマウスの2つの遺伝子座が加齢性難聴抵抗性に寄与する
日本産野生マウスから樹立されたMSM/Ms(MSM)マウスは、肥満、炎症、腫瘍形成など加齢に伴って発症する様々な病気になりにくいマウスです。加齢性難聴抵抗性もMSMマウスの特徴で、多くのマウスは加齢が進むに従って聴力の低下が認められますが、MSMマウスの聴力は長期に渡って維持されます(図1)。MSMマウスの加齢性難聴抵抗性にはこれまで17番染色体上のahl3遺伝子座が関与していることが報告されていました。そこで私たちは、カドヘリン23遺伝子のahlアレルを持つことによって加齢性難聴を発症するC57BL/6Jマウスのahl3遺伝子座を、MSMマウスの相同領域と置換したahl3コンジェニックマウスを作製して、聴力レベルの変化を調査しました。その結果ahl3コンジェニックマウスは中高周波難聴の発症が有意に遅延していることが明らかとなりました(図2)。さらに、私たちは、MSM系統の別の加齢性難聴の発症を抑制する遺伝子座、ahl10を12番染色体上に同定しました。次にahl3遺伝子座と同様に、C57BL/6Jマウスのahl10遺伝子座をMSMマウスの相同領域と入れ替えたahl10コンジェニックマウスを作製し、聴力レベルを調査した結果、ahl10コンジェニックは高音域で加齢性難聴の発症が遅延することが認められました(図3)。このような加齢性難聴の抵抗性に関する知見はほとんど知られていません。従ってMSMマウスのゲノム上のahl3およびahl10遺伝子座は加齢性難聴の予防法や治療法を確立するための新しい重要なターゲットになると私たちは考えています。
本研究は日本学術振興会基盤研究(B)(15H04291)、挑戦的研究(萌芽)(21K19196)、基盤研究(C)(21K09643)、特別研究員奨励費(14J06119)、および革新的先端研究開発支援事業(AMED-CREST)(22gm1510004)の助成を受け実施しました。