

公益財団法人
東京都医学総合研究所
脳・神経科学研究分野
認知症プロジェクト
〒156-8506
東京都世田谷区上北沢2-1-6
TEL 03-6834-2349
FAX 03-6834-2349
2016年1月28日
英国科学雑誌「Human Molecular Genetics」オンライン版に田中 良法 研究員、野中 隆 副参事研究員、 鈴木 元治郎 主席研究員、亀谷 富由樹 主席研究員、長谷川 成人 参事研究員らが発表
筋萎縮性側索硬化症(ALS)は、運動を制御する神経細胞が変性・脱落することによって重篤な筋肉の萎縮と筋力低下を引き起こす神経変性疾患です。ALSの発症機構は解明されていませんが、孤発性※1及び多くの家族性※2ALSの患者脳・脊髄において、「TDP-43※3」という本来細胞の核に存在するタンパク質が細胞質で凝集・蓄積することが知られています。TDP-43の核内における働きは細胞の生存にとって不可欠であるため、細胞質におけるTDP-43の蓄積はALSの発症に重要な役割を担っていると考えられています。病的なTDP-43はアミロイド様の線維状構造をとり、リン酸化などの修飾を受けて細胞内に蓄積していますが、プリオン病の原因タンパク質である異常プリオン※4のように、正常なTDP-43を異常型に変換する性質があることが知られています。
近年、家族性ALSの原因としてプロフィリン1遺伝子(PFN1)の変異が同定されました。これまでの研究によって、PFN1の変異をもつ患者さんではTDP-43の細胞質内蓄積が認められること、培養細胞を用いた解析では、変異型プロフィリン1とTDP-43が細胞質内で共凝集体を形成することが示されてきました。
そこで本研究では、変異型プロフィリン1とTDP-43の蓄積の関係について詳細な解析を行いました。
PFN1の変異効果を調べるため、変異型プロフィリン1を培養細胞に発現させたところ、変異型プロフィリン1は不溶性の凝集体を細胞質内に形成すること(参考図1)、またその一部にTDP-43が共局在することがわかりました。TDP-43と変異型プロフィリン1を培養細胞に同時に発現させると、TDP-43の蓄積が亢進し、一部は病的なTDP-43のようにリン酸化されていることがわかりました。さらに、その細胞の不溶画分をTDP-43発現細胞に導入した場合にも、TDP-43の蓄積亢進とリン酸化TDP-43の蓄積が確認されました。以上のことから、ALSの原因となるPFN1の変異により、プロフィリン1の凝集体が形成され、それがTDP-43を補足することにより病的なTDP-43が形成されやすくなること、さらには病的なTDP-43がそのプリオン様性質により正常TDP-43を病的なTDP-43に変換して、TDP-43の蓄積を促進することが考えられます(参考図2)。
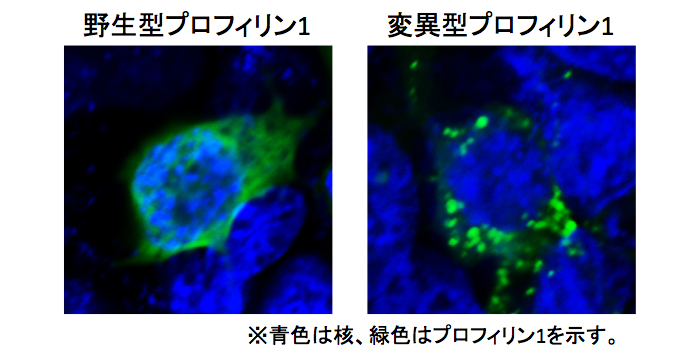
左の「野生型」のプロフィリン1を発現させた細胞では核や細胞質内に瀰漫性(びまんせい)にプロフィリン1が局在している。一方、右の「変異型」のプロフィリン1を発現させた細胞では細胞質内に顆粒状のプロフィリン1(プロフィリン1凝集体)が局在していることがわかる。
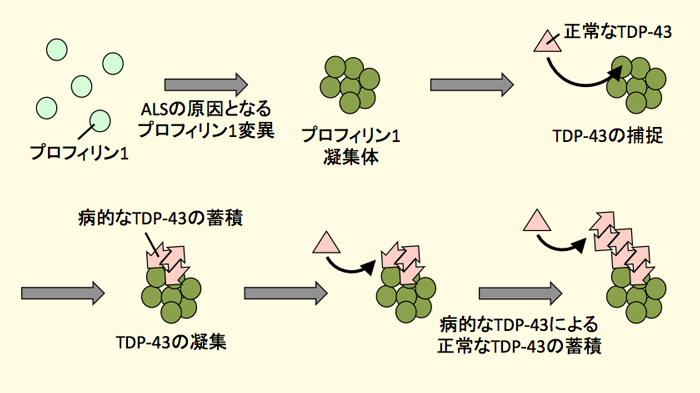
プロフィリン1はALSの原因となる変異によって凝集体を形成する。プロフィリン1凝集体は正常なTDP-43を補足し、病的なTDP-43が形成されやすくなる。病的なTDP-43は正常なTDP-43を病的なTDP-43に変換し、TDP-43の蓄積が進行する。
Copyright © 2023 Tokyo Metropolitan Institute of Medical Science. All Rights Reserved.