

公益財団法人
東京都医学総合研究所
脳・神経科学研究分野
認知症プロジェクト
〒156-8506
東京都世田谷区上北沢2-1-6
TEL 03-6834-2349
FAX 03-6834-2349
2022年9月15日
認知症プロジェクトの長谷川成人プロジェクトリーダーらは、英国MRC Laboratory of Molecular Biologyの Michel Goedert, Sjors Scheresグループリーダーらとの共同研究により「パーキンソン病とレビー小体型認知症のαシヌクレイン線維構造の同一性」について英国科学雑誌「Nature」に発表しました。
“Structures of α-synuclein filaments from human brains with Lewy pathology”
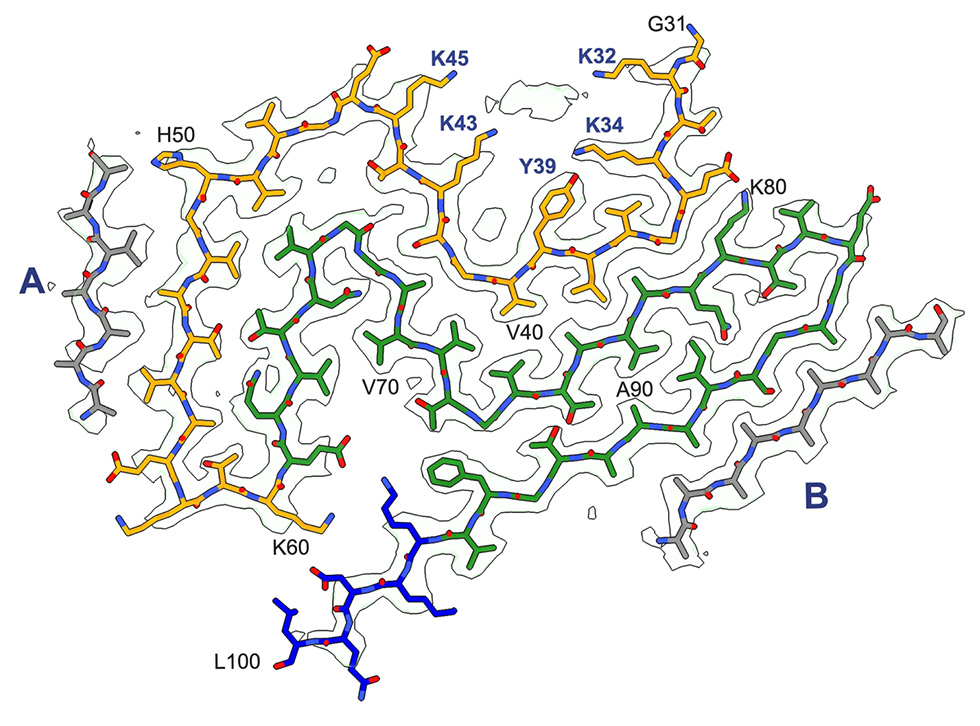
MRC分子生物学研究所の神経生物学部門のMichel Goedert博士と構造研究部門のSjors Scheres博士のグループは、長年の共同研究を基に、電子低温顕微鏡法(クライオ電子顕微鏡)を用いて、パーキンソン病とレビー小体型認知症の脳から採取したαシヌクレイン線維の構造を決定しました。この線維の形成は、神経細胞の変性やこれらの疾患の症状を引き起こすと考えられています。
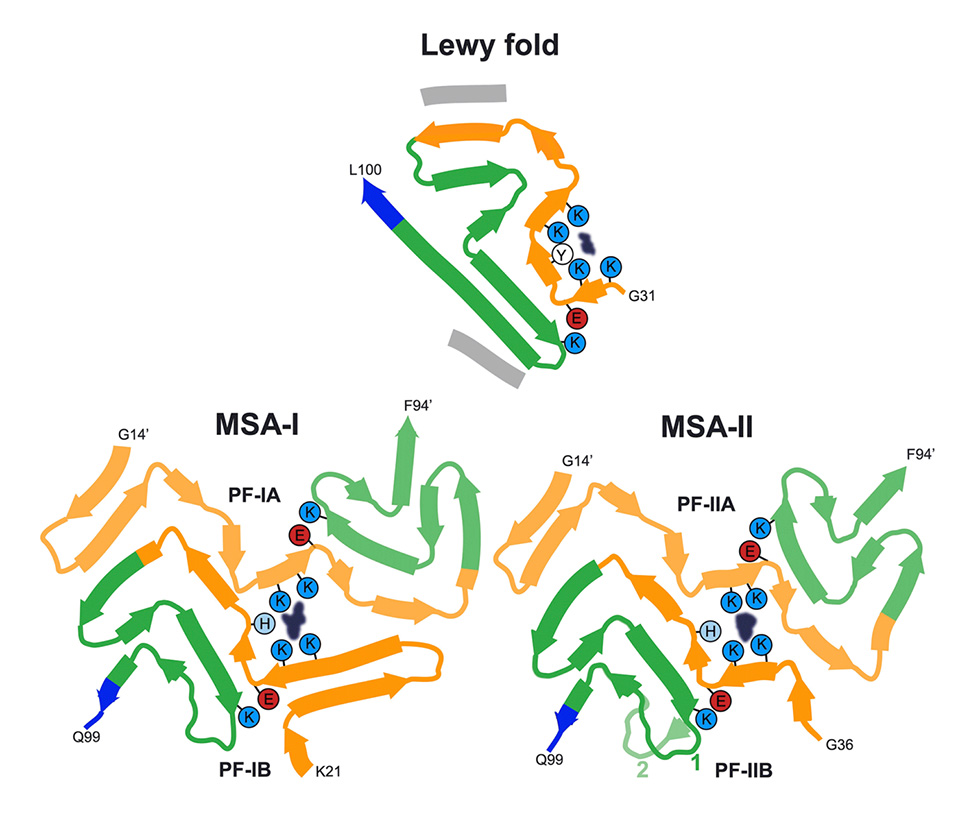
今回の研究成果は、神経変性疾患の中で2番目に多く、最も一般的な運動障害であるパーキンソン病のレビー小体病変から、これまで知られていなかったαシヌクレイン線維の構造を報告したものとして、非常に重要なものです。また、この線維の構造は、レビー小体型認知症の人の脳の線維と同じであることも明らかにしました。研究グループは、このαシヌクレインの構造をレビーフォールドと命名しました。
両疾患でαシヌクレインの線維構造が同じであることは、両疾患が連続体であることを示しています。研究グループはこれまでに、多系統萎縮症(MSA)のαシヌクレイン線維の構造を決定してきましたが、レビー小体型とは大きく異なっていました。
今回の研究により、シヌクレイノパチーには複数の分子コンフォマーが存在することが証明されました。研究グループは3つの主要なシヌクレイノパチーから得られたαシヌクレインのフォールドを決定したことになります。パーキンソン病、レビー小体型認知症、MSAです。
αシヌクレイン線維の構造を知ることは、レビー小体病やMSAのより良い診断法の開発に役立つと考えられます。現在では、レビー小体病やMSAに特異的なPETリガンドとして開発できる低分子化合物を、構造に基づいて設計することが可能かもしれません。このようなリガンドは、ヒトの脳内でαシヌクレイン凝集物を予兆として検出するために必要であり、メカニズムに基づいた治療法とともに、病気の症状を予防するための必須条件となるものです。また、今回の成果は、ヒトの脳と同じ構造のαシヌクレイン線維を作製する方法の開発にも道を開くものです。長期的には、パーキンソン病やレビー小体型認知症に対する新しいメカニズムに基づく治療法の開発につながる可能性があります。
筆頭著者のYang Yangは、Yang ShiとManuel Schweighauser(いずれもLMBポスドク)の協力を得て、低温電子顕微鏡分析を実施しました。研究チームは、サーモフィッシャーサイエンティフィックのAbhay Kotecha氏から提供された高度な電子顕微鏡を使用しました。脳サンプルは、当研究所の長谷川プロジェクトリーダーの他、UCL Queen Square Institute of NeurologyのTammaryn Lashley氏、インディアナ大学医学部のBernardino Ghetti氏から提供されました。
本研究は、UKRI MRC、Alzheimer's Research UK、National Institute for Health Research Queen Square Biomedical Research Unit in Dementia、Rita Lila Weston Institute for Neurological Studies、科学技術振興機構(CREST)、日本医療研究開発機構(AMED)、米国国立衛生研究所、Indiana University School of Medicine病理・検査医学科から資金援助を受けました。
Copyright © 2023 Tokyo Metropolitan Institute of Medical Science. All Rights Reserved.