ホーム > 研究内容 > 吉田チーム
研究内容 【吉田チーム】
糖鎖認識ユビキチンリガーゼに基軸をおいた細胞質における糖鎖生物学
メンバー
| 研究員 | 吉田 雪子 |
|---|---|
| ポスドク | 木下 大生 |
| 研究補助員 | 安藤 力 |
| 研究補助員 | 吉田 芽亜利 |
研究内容の紹介
細胞外タンパク質の多くに見られる糖鎖修飾。タンパク質の糖鎖修飾は細胞内で膜に囲まれた小器官(オルガネラ)である小胞体やゴルジ体で行われた後、糖タンパク質は各々の目的地である細胞外や他のオルガネラへと移動します。通常、糖タンパク質は細胞質には存在しません。最近の研究で、ある異常な状況(細菌感染やタンパク質のフォールディング異常)で細胞質に糖タンパク質が現れることがわかってきました。私達は、ユビキチンをキーワードに細胞質に出現した糖タンパク質が関わる現象を研究しています。
ユビキチン修飾系
ユビキチン修飾系はE1(ユビキチン活性化酵素)-E2(ユビキチン結合酵素)-E3(ユビキチンリガーゼ)の3種類の酵素の働きにより、標的蛋白質にユビキチンを付加させる翻訳後修飾です。多くの場合、この一連の酵素反応(ユビキチン化反応)が繰り返されることによりユビキチンが鎖のように連なるユビキチン鎖が形成されます。
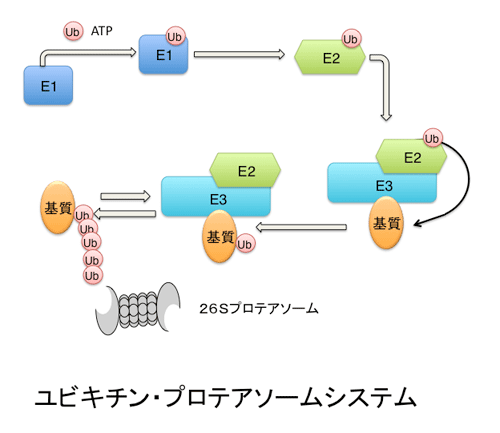
これらユビキチン修飾系の中で、ユビキチンリガーゼE3が基質の識別をおこなう最も重要な酵素です。細胞内で動的・選択的に基質の識別を行うユビキチンリガーゼはリン酸化などの可逆的な翻訳後修飾を認識するものが多く知られてきていました。私達はN結合型糖鎖を認識してユビキチン化を行う E3 SCFFbsを見出し、その機能解析を行っています。
F-boxタンパク質
SCFFbsというのは E3 複合体の名称です。E3 には、単独で働くものと複合体型ものが存在します。ヒトではおよそ600種類のE3が存在するといわれています。複合体型のものでは、 SCF 複合体と呼ばれる Skp1-Cul1-Roc1-F-box 蛋白質の4量体からなるものがよく知られています。この4量体のうち、基質と直接結合する F-box 蛋白質を入れ替えることで多様な基質に対応することができます。(ルールとしてSCF複合体の F-box 蛋白質の名前を小さく右肩に記載することになっています)SCFFbsは F-box 蛋白質がFbs (糖鎖 sugar chainを認識する F-box)である SCF 複合体ということです。
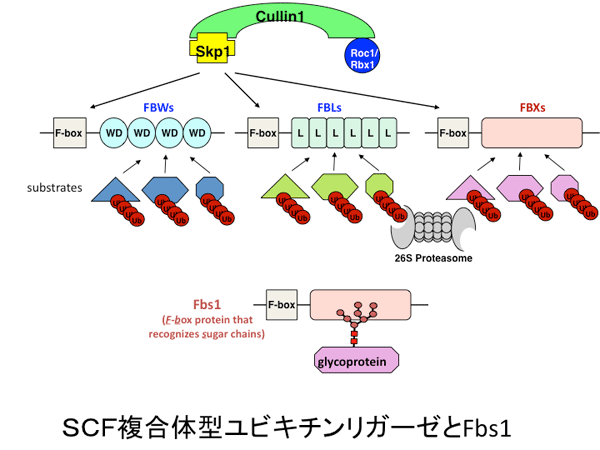
F-boxタンパク質はヒトではおよそ70種類存在しますが、細胞内での機能がわかっているものはその半分くらいです。私達は糖鎖を認識する3種類のF-boxタンパク質(Fbs1, Fbs2, Fbs3)を発見し、その機能解析を行っています。
SCFFbsの細胞内機能
(1)小胞体関連分解
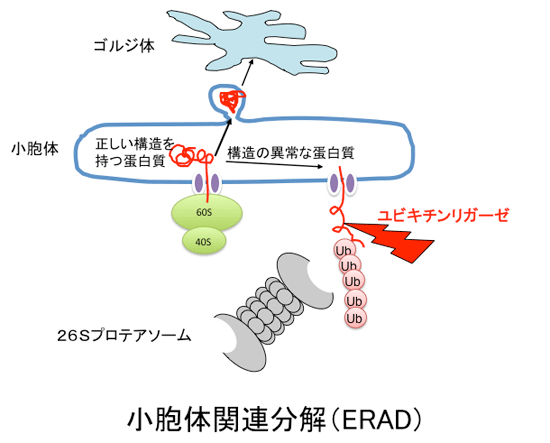
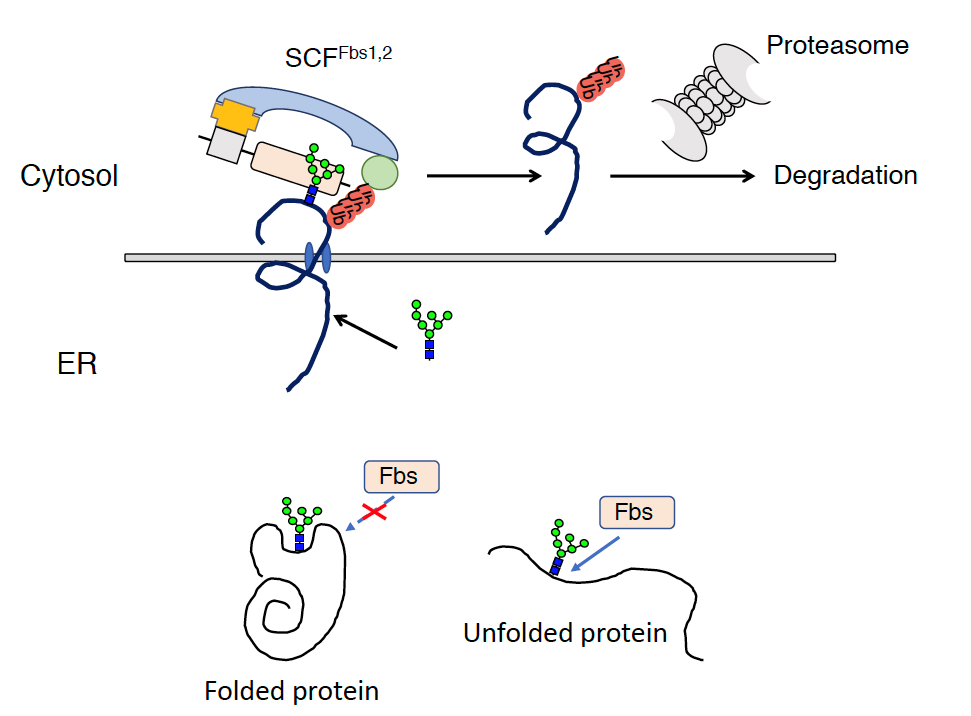
細胞外へ分泌されるタンパク質や膜タンパク質は粗面小胞で翻訳された後、小胞体に送られると同時に、小胞体の入り口で糖鎖が付加されます。小胞体の中では正しい立体構造に折り畳まれ(フォールディング)ますが、正しい立体構造がとれなかったものや、余剰のサブユニットは小胞体から細胞質に押し戻され(逆行輸送)、細胞質でユビキチン・プロテアソーム系により分解されるという細胞の「品質管理機構」がしられています。この品質管理機構は「小胞体関連分解」と呼ばれています。私達の見出した糖鎖認識F-boxタンパク質のうちFbs1とFbs2は、フォールディングができなかった際に現れる糖鎖の根元を認識することから、小胞体関連分解に関与していると考えています。
(2) オルガネラダメージ
Fbs3は他の2つの糖鎖認識F-boxタンパク質と異なり、ミリストイル化という脂質修飾を受けることで細胞内のオルガネラ膜に結合するという特徴を持っています。そのため、細菌感染や細胞外から取り込まれた異常物(シリカなど)により、オルガネラ膜に損傷を受けると、そこから露出するオルガネラ内の糖タンパク質糖鎖を認識して素早く集積し、オルガネラ全体をユビキチン化することでオートファジーを誘導します。そして、細胞内から損傷オルガネラが取り除かれます。私達は、リソソーム膜を人工的に傷害する系を用いて、Fbs3が損傷リソソームに集積することリソソーム内の糖タンパク質LAMP2をユビキチン化することでオートファジーが誘導されることを見出しています。
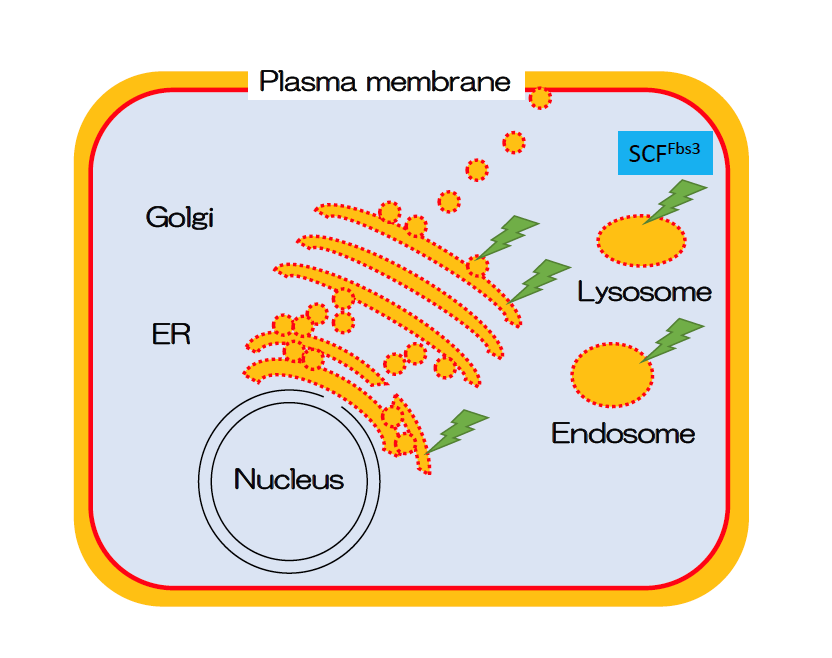
図:Fbs3はオルガネラ損傷を見出し、ユビキチン化し、オートファジーを誘導することで異常を取り除く
以上のことから、Fbsは、細胞質に現れた糖鎖を「異常」として感知し、その異常を取り除く細胞内品質管理をおこなっていると考えています。
研究の進め方
糖鎖の生合成系から、細胞外もしくは糖鎖はオルガネラ内に存在するものと考えられてきましたが、Fbs以外にも細胞質には糖鎖認識分子のレクチンや糖鎖除去酵素が存在します。細胞質におけるFbsの機能解析をさらに進めると共に、細胞質における未知の糖鎖認識分子の解析も行っていくことで細胞質の糖鎖のもつ意義を解明することを目指しています。
主要論文
- Yoshida, Y., Chiba, T., Tokunaga, F., Kawasaki, H., Iwai, K., Suzuki, T., Matsuoka, K., Yoshida, M., Tanaka, K. & Tai, T. E3 ubiquitin-ligase that recognizes sugar chains. Nature 418, 438-442 (2002).
- Yoshida, Y., Tokunaga, F., Chiba, T., Iwai, K., Tanaka, K. & Tai, T. Fbs2 is a new member of the E3 ubiquitin ligase family that recognizes sugar chains. J. Biol. Chem. 278, 43877-43884, (2003).
- Mizushima, T., Hirao, T., Yoshida, Y., Lee, S. J., Chiba, T., Iwai, K., Yamaguchi, Y., Kato, K., Tsukihara, T., Tanaka, K. Structural basis of sugar-recognizing ubiquitin ligase. Nature Struct. Mol. Biol.,11, 365-370, (2004).
- Yoshida, Y., Adach, E., Fukiya, K., Iwai, K., & Tanaka, K. Glycoprotein-specific ubiquitin ligases recgnize N-glycans in unfolded subsrates. EMBO reports 6, 239-244, (2005).
- Yoshida, Y., Murakami, A., Iwai, K., & Tanaka, K. A neural-specific F-box protein Fbs1 functions as a chaperone suppressing glycoprotein aggregation. J. Biol. Chem. 282, 7137-7144, (2007).
- Mizushima, T., Yoshida, Y., Hirao, Kumanomidou, T., Hasegawa, Y., Suzuki,A., Yamane, T., & Tanaka, K. Structural basis for the selection of glycosylated substrates by SCFFbs1 ubiquitin ligase. Proc. Nat. Acad. Sci. U. S. A. 104, 5777-5781,(2007).
- Yoshida, Y., Murakami, A., & Tanaka, K. Skp1 stabilizes the conformation of F-box proteins. Biochem. Biophys. Res. Commun. 410, 24-28, (2011).
- Yoshida, Y., Saeki, Y., Murakami, A., Kawawaki, J., Tsuchiya, H., Yoshihara, H., Shindo, M. & Tanaka, K. A comprehensive method for detecting ubiquitinated substrates using TR-TUBE.
Proc. Nat. Acad. Sri. U.S.A. 112, 4630-4635, (2015).
- *Yoshida, Y., Yasuda, S., Fujita, T., Hamasaki, M., Murakami, A., Kawawaki, J., Iwai, K., Saeki, Y., Yoshimori, T., Matsuda, N., and *Tanaka, K. Ubiquitination of exposed glycoproteins by SCFFBXO27 directs damaged lysosomes for autophagy. Proc. Natl. Acad. Sci. USA 114(32): 8574-8579 (2017)
総説
- Yoshida, Y. A novel role for N-glycans in the ERAD system.J. Biochem. 134, 183-190, (2003).
- Yoshida, Y. Expression and assay of glycoprotein-specific ubiquitin ligases. In ‘the Ubiquitin-Proteasome System’ Methods in Enzymology (Eds. by Deshaies, R.J., Hershko, A., Jentsch, S., Pickart, S., and Tanaka, K. Academic Press , 398, 159-169, (2005).
- Yoshida, Y. F-box proteins that contain sugar-binding domains. Biosci. Biotechnol. Biochem. 71, 2623-2631, (2007).
- Yoshida, Y. & Tanaka, K Lectin-like ERAD players in ER and cytosol. Biochimica et Biophysica Acta. 1800, 172-180, (2010).
- 吉田雪子:糖鎖によるタンパク質の品質管理機構. 生化学 ,74, 1455-1459, 2002.
- 吉田雪子:小胞体関連タンパク質分解. 実験医学増刊「タンパク質修飾・分解の新機能に迫る」 ,22, 155-162, 2004.
- 吉田雪子:タンパク質分解シグナルとしての糖鎖機能の発見. 日本農芸化学会誌 ,78, 1056-1061, 2004.(平成16年度 日本農芸化学会奨励賞受賞総説)
チームリーダー プロフィール
吉田 雪子(研究員)
略歴
| 1986年 | 北海道大学農学部農芸化学科卒業 |
| 1986~1989年 | (株)日本ゼオン勤務 (微生物のスクリーニング・特許・社会人としての姿勢を学びました) |
| 1994年 | 東京大学大学院農学系研究科応用生命工学専攻修了 博士(農学)(ジャガイモYウイルスのプロテアーゼに関する研究 (指導教官:魚住武教授):分子生物学の基本を学びました) |
| 1994~1997年 | 理化学研究所・フロンティア研究システム・糖遺伝学情報チーム・研究員(辻崇一先生主宰:遺伝子ハンターとしての腕を磨きました。糖鎖と出会いました。) |
| 1998年~ | (財)東京都臨床医学総合研究所(後に東京都医学総合研究所に改組)・研究員 (糖鎖の機能を知るために、糖鎖結合蛋白質のスクリーニングを行い、F-box蛋白質に至ったために現在の分解の道に足を踏み入れました。勉強の毎日です) |
