Research
研究紹介
糖鎖認識ユビキチンリガーゼに基軸をおいた細胞質における糖鎖生物学と創薬
蛋白質の糖鎖修飾は、細胞内の膜で囲まれた小器官(オルガネラ)である小胞体やゴルジ体で行われ、完成した糖蛋白質は細胞外や他のオルガネラへと移動します。そのため、糖蛋白質は細胞質に存在しないと考えられてきましたが、最近の研究で、細菌感染や蛋白質のフォールディング異常により細胞質にも糖蛋白質が一時的に現れることがわかってきました。
私達は、糖鎖を認識するユビキチン付加酵素(ユビキチンリガーゼ:E3)を細胞質に見出して以来、細胞質の糖鎖に着目し、糖鎖認識ユビキチンリガーゼの機能についての研究を行っています。
☆ 糖鎖認識ユビキチンリガーゼについて
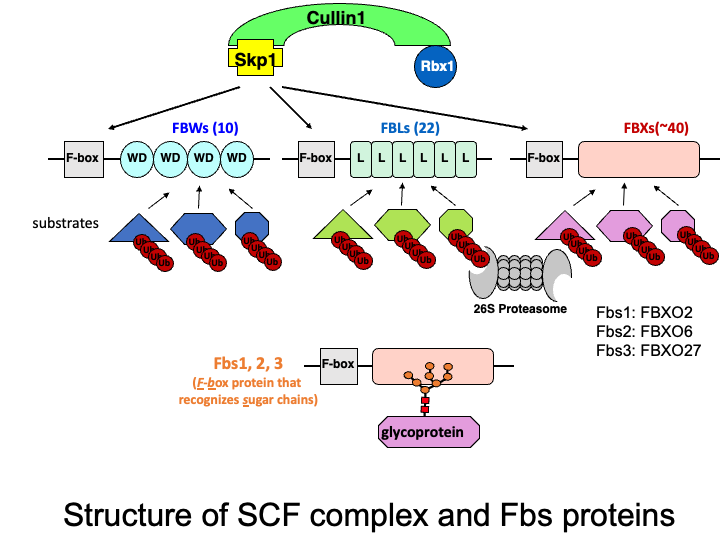
真核生物における選択的蛋白質分解を司るユビキチン−プロテアソームシステム。その選択制の鍵を握っているのがE3です。E3は哺乳類では600種類以上存在すると考えられており、単独の蛋白質として機能するE3以外に複合型のE3も存在します。SCF型E3はCul1-Rbx1-Skp1-F-box蛋白質からなり、基質結合サブユニットであるF-box蛋白質が入れ代わることで、様々な基質に対応します。F-box蛋白質はヒトではおよそ70種類くらい存在しますが、私達は3種類の糖鎖を認識するF-box蛋白質(F-box protein recognizing sugar chains: Fbs1, Fbs2, Fbs3)に関してその機能解析を行っています。
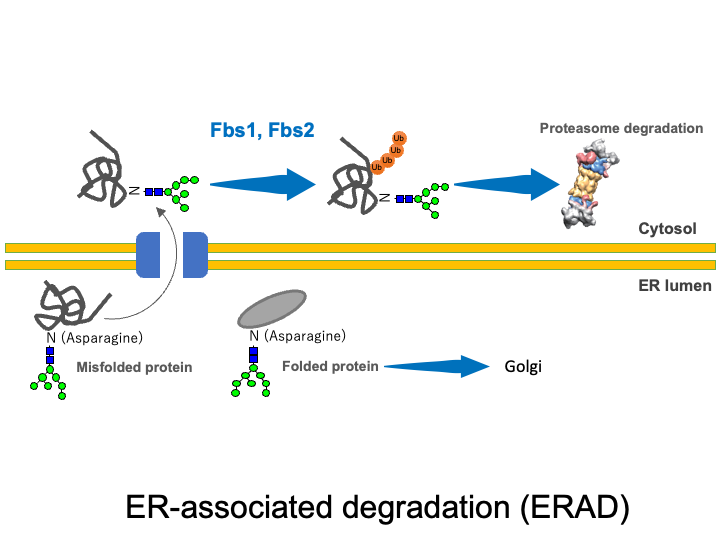
☆ 小胞体関連分解
分泌蛋白質や膜蛋白質などの細胞外蛋白質は粗面小胞で翻訳された後、小胞体に入り、そこで糖鎖が付加されます。小胞体の中ではシャペロンの助けを借りて立体構造形成(フォールディング)が行われますが、立体構造が正しくとれなかったものや余剰のサブユニットは小胞体から細胞質に戻され(逆行輸送)、細胞質でユビキチン・プロテアソーム系により分解される品質管理機構(小胞体関連分解:ERAD)が知られています。Fbs1とFbs2はフォールディングに失敗した変性状態で現れる糖鎖の根元( N型糖鎖で共通に存在するGlcNAc-GlcNAc構造)を認識し、この小胞体関連分解に関与するものと考えています。
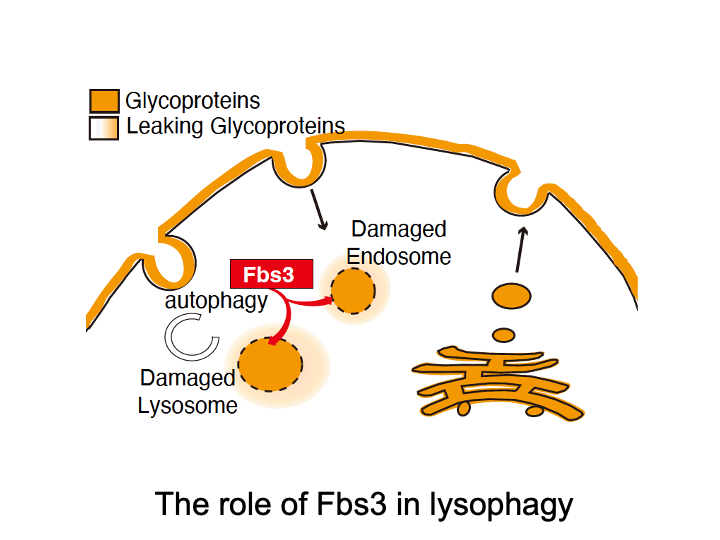
☆ リソソーム損傷
Fbs3という糖鎖認識ユビキチンリガーゼはミリストイル化という脂質修飾を受け細胞内のオルガネラ膜に結合する特徴を持っています。そのため、細菌感染や細胞外から取り込まれた微粒子によりリソソーム膜損傷を受けると、そこから露出するオルガネラ内のLAMP2という糖蛋白質糖鎖を目印に素早く集積しオルガネラ全体をユビキチン化することでオートファジーを誘導し、損傷リソソームを除去することを見出しました。この現象はリソファジーと呼ばれています。
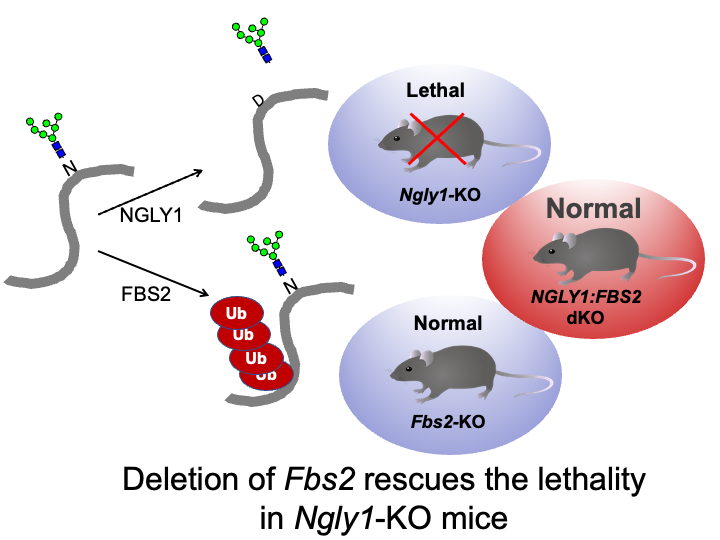
☆ NGLY1欠損症への関与
細胞質には糖鎖認識ユビキチンリガーゼ以外にも、糖鎖を除去するNGLY1(PNGase)と言う酵素が存在し、小胞体関連分解にかかわるものと考えられてきました。エクソーム解析により、NGLY1に変異を持つ超希少疾患NGLY1欠損症という全身性の重篤な疾患が報告されました。NGLY1の発見者である理化学研究所の鈴木匡主任研究員は、NGLY1-KOマウスは胎生致死となることを報告していました。しかし、私達はFbs2のKOマウスと掛け合わせることでほぼ正常に生まれ、生育することを偶然見出しました。また、NGLY1が発現しない培養細胞にこの糖鎖認識ユビキチンリガーゼを発現させると、プロテアソーム活性の阻害が起こり、細胞死がみられました。これらのことより、糖鎖認識ユビキチンリガーゼの阻害剤はNGLY1欠損症の治療薬になると考えられ、鈴木博士らと共にその創薬研究も開始しています。さらに、糖鎖認識リガーゼによるプロテアソーム阻害が生じる詳細な機構を解明すべく、研究を進めています。
プロテアソームの細胞内動態
プロテアソームはスーパーバイザーである田中啓二理事長が発見した33種類のサブユニットが集合して形成される巨大な複合体型の蛋白質分解酵素です。佐伯泰博士(現東京大学医科学研究所教授)はこのプロテアソームのサブユニットのひとつに蛍光蛋白質を付けることで細胞内の動態解析を行いました。現在、遠藤研究員が中心になり、様々なストレス下におけるプロテアソームの動態変化を解析し、興味深い現象を次々解明しつつあります。
ユビキチン・プロテアソーム系の包括的解析
ユビキチンは76アミノ酸からなる小さな蛋白質ですが、ユビキチン内の7つのリジンと開始メチオニンを介して8種類のユビキチン鎖(厳密には更なる複雑な鎖もあり)を形成することで様々な機能を発揮します。最もよく知られているのは48番目のリジンを介したK48鎖がプロテアソームによる分解シグナルとして機能することですが、これまで、このK48鎖が何によって捕捉されプロテアソームに輸送されるのかその詳細な機構を土屋研究員等は明らかにしてきました。現在、佐伯教授との共同研究で、土屋研究員はユビキチン化基質をプロテアソームへ運搬するシャトル分子の網羅的解析を、冨田研究員は蛋白質複合体の品質管理機構の解析を進めています。
プロテアソーム変異マウスの機能解析
プロテアソーム機能の破綻は神経変性疾患など様々な疾患を引き起こすと考えられています。しかしながら、プロテアソームの機能は全ての細胞生存に必須であるため、個体レベルでの病態生理学的解析が大きく立ち遅れています。そこで当研究室では、発達障害患者より見出されたプロテアソーム構成サブユニットPSMD12のヘテロ変異をモデルとし、全身性プロテアソーム機能減弱マウスを作出しました。現在、土屋研究員と米川研究員は個体レベルでのプロテアソームの機能解析に取り組んでいます(佐伯教授との共同研究)。

