
2024年1月6日
蛋白質代謝研究室の遠藤彬則主任研究員らは、東京工業大学の駒田雅之教授・福島俊明助教ら、東京大学医科学研究所の佐伯泰教授(前蛋白質代謝プロジェクトリーダー)と共同で、新たなオルガネラストレスとしてエンドソームストレスを発見し、エンドソームストレスが免疫応答を誘導することを米国科学誌 JCB に発表しました。
当研究所 蛋白質代謝研究室の遠藤彬則主任研究員・吉田雪子研究室長、田中啓二理事長らは、東京工業大学の駒田雅之教授・福島俊明助教ら、東京大学医科学研究所の佐伯泰教授(公益財団法人東京都医学総合研究所前プロジェクトリーダー)と共同で、新たなオルガネラストレスとしてエンドソームストレスを発見し、エンドソームストレスが免疫応答を誘導することを明らかにしました。本研究成果は、オルガネラ研究の新たな道筋を示すことが期待されます。
この研究成果は2024年1月6日(土)午前0:00(日本時間)に米国科学誌「JCB 」のオンライン版に掲載されました。
“USP8 prevents aberrant NF-kB and Nrf2 activation by counteracting ubiquitin signals from endosomes”
(USP8はエンドソーム上からユビキチンを取り除くことでNF-kBとNrf2の過剰な活性化を防ぐ)
Journal of Cell Biology (JCB)
DOI:10.1083/jcb.202306013
URL:https://doi.org/10.1083/jcb.202306013
膜タンパク質の局在を司る細胞内ネットワークである細胞内膜輸送(メンブレントラフィック)(注1)において、エンドソーム(注2)は、主要なタンパク質修飾の一つであるユビキチン化(注3)と連携して、メンブレントラフィックのハブとして働くオルガネラ(細胞内小器官)です。一連のエンドソーム構成因子、そして私たちが解析を続けてきたエンドソーム機能維持に必須の脱ユビキチン化酵素USP8(注4)の機能欠損は、マウスにおいて致死性を示すことから、エンドソームが個体の生存、発生に不可欠であることが示されていました。しかし、恒常的なエンドソーム機能不全が細胞死を導くことが半ば自明である一方で、可逆的かつ一過的なエンドソーム機能の欠損が細胞に与える影響はこれまで研究されていませんでした。そこで、私たちは、機能不全に陥ったエンドソームに過度のユビキチンが蓄積した状態を新たなオルガネラストレス(注5)・エンドソームストレスとして捉え、可逆的・一過的なエンドソームストレスの解析を始めました。
まず、質量分析計を用いたプロテオーム解析(注6)により、エンドソームストレスが細胞のタンパク質発現量へ与える効果を網羅的に調べました。興味深いことに、エンドソームストレスを起こした細胞では免疫応答・ストレス応答が誘導されることが明らかになりました。さらに、これら免疫応答・ストレス応答が遺伝子発現を介して引き起こされることがわかりました。このことは、エンドソームストレスを感知し、遺伝子発現をコントロールする分子機構が細胞に備わっていることを示しています。
次に、どのようにエンドソームストレスが遺伝子発現を制御するのか、その詳細なメカニズムを調べました。その過程で、私たちはユビキチンを認識して様々な分子機能を発揮する、ユビキチン結合タンパク質に注目し、解析を進めました。そして、エンドソームに蓄積したユビキチンをユビキチン結合タンパク質TAB2とp62が認識し、NF-kBを介した免疫応答とNrf2を介したストレス応答を引き起こすことを明らかにしました。
また、酸化ストレスなど細胞環境の変化がエンドソームストレスの引き金となり、免疫応答などを誘導すること、エンドソームストレスで増加したサイトカインなどが細胞間シグナル伝達(コミュニケーション)を仲介することから、生理下でエンドソームストレスが生体機能を制御する可能性が示唆されました。
私たちは、新たにオルガネラストレスと提唱したエンドソームストレスが細胞内シグナル伝達経路を活性化することを報告しました。これまでにER(小胞体)ストレスやミトコンドリアストレスなどのオルガネラストレスの研究が盛んに進められ、その生物学的重要性が次々に明らかになっています。今回のエンドソームストレスの発見とその研究成果が生物学の進展に広く貢献することを期待します。
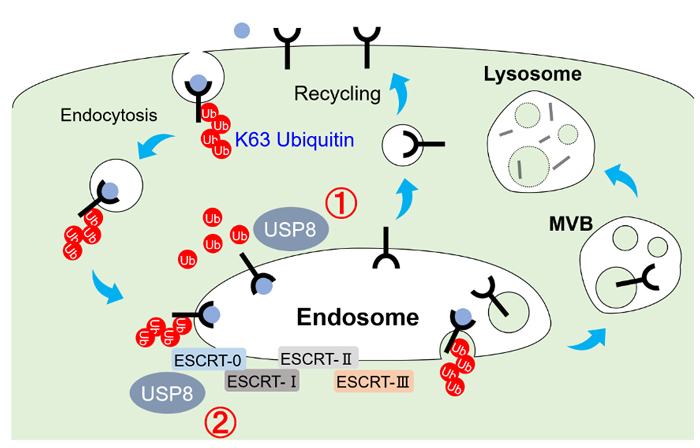
細胞膜に局在する増殖因子受容体は、細胞外のリガンドと結合すると活性化し、細胞内へシグナルを伝達するとともに、ユビキチン化(主にK63ユビキチン鎖)され、エンドサイトーシスにより細胞内へと取り込まれる。エンドソームへ運ばれた受容体は、ユビキチン依存的にその後の運命が決定される。ユビキチン化受容体は、ESCRT群に認識され、リソソームへ輸送・分解される一方、ユビキチンを取り外された受容体は、再び細胞膜へ輸送され、再利用される。脱ユビキチン化酵素USP8は、受容体の脱ユビキチン化(①)、ESCRTの安定を介したリソソーム輸送経路の維持(②)などにより、エンドソーム機能に必須の役割を果たす。
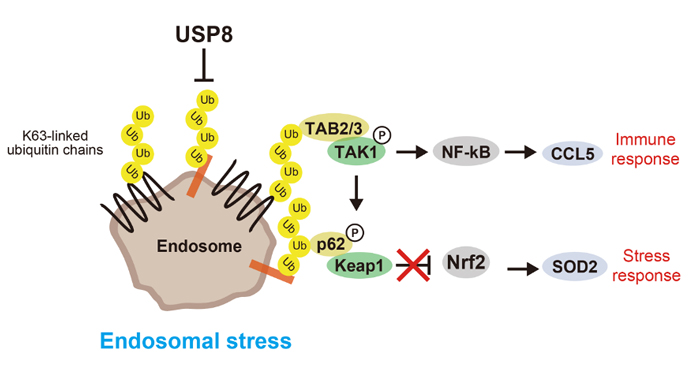
USP8やエンドソーム構成因子の阻害により、過度のユビキチン化タンパク質がエンドソームへ蓄積した状態をエンドソームストレスと定義した。エンドソームに蓄積したユビキチン鎖と結合したTAB2/3とp62がそれぞれTAK1―NF-kB経路の活性化を介した免疫応答とKeap1―Nrf2経路の活性化を介したストレス応答を誘導する。
日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(PRIME)「プロテオスタシスの理解と革新的医療の創出」研究開発領域における研究開発課題「ユビキチン依存的なプロテアソーム相分離によるプロテオスタシス制御」(研究開発代表者:遠藤彬則)(21gm6410012)、日本学術振興会(JSPS)科学研究費補助金などの支援を受けておこなわれました。