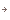研究内容
2022-01-28
研究の背景
スフィンゴ糖脂質(Glycosphingolipid)は細胞膜の構成成分の一つで、脂質部分が膜に埋め込まれ糖鎖部分が細胞外に露出したかたちで細胞表層に存在している。その構造的特徴から細胞の認識機構に関与するものと予想されてきて、近年スフィンゴ糖脂質は個体発生に必須であることがスフィンゴ糖脂質生合成酵素の遺伝子ノックアウト実験により証明された。しかし、スフィンゴ糖脂質の生体内における役割についてはまだ解明されておらず、ポストゲノム時代における重要な研究標的として残されている。
シアル酸を含むスフィンゴ糖脂質であるガングリオシドは脳神経系に多く発現しており、総膜脂質量の約10%を占めている。多様な分子群として発現しているガングリオシドは以前より脳の発生段階において組成が顕著に変化することから、脳神経の機能に何らかの関与をすることを示唆されていた。
研究テーマ1:神経ラフト機能
スフィンゴ糖脂質結合タンパク質の単離
スフィンゴ糖脂質が機能を発現する方法として、何等かのタンパク質と会合しその機能を調節している可能性が考えられた。そこで抗スフィンゴ糖脂質抗体で免疫沈降することにより、想定される「スフィンゴ糖脂質会合タンパク質」が共沈し、単離同定が可能になるのではないかと考えた(図1)。そして小脳顆粒神経細胞を使って抗ガングリオシドGD3抗体で免疫沈降し、γ32P-ATPを加えin vitro kinase assayをおこなったところ、40, 53, 56, 80kDaタンパク質のリン酸化が検出された。40kDaタンパク質は三量体Gタンパク質Goのαサブユニット(Goα)、53/56kDaタンパク質はsrcファミリーチロシンキナーゼLyn、80kDaタンパク質がCbp (Csk-binding protein)であることが、それぞれ特異的抗体を用いた再免疫沈降実験からわかった。さらに小脳顆粒神経細胞の表面タンパク質をヨード125で標識したところ、抗ガングリオシドGD3抗体で共沈する135kDaタンパク質がGPIアンカー神経細胞接着分子TAG-1であることもわかった。
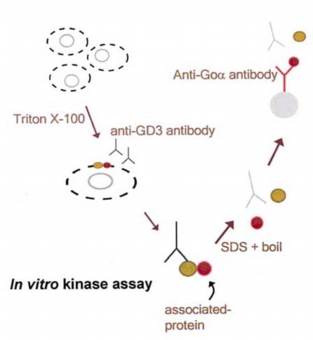
図1: スフィンゴ糖脂質会合タンパク質の単離方法
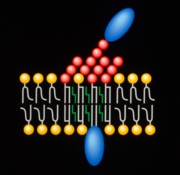
最近、スフィンゴ糖脂質およびスフィンゴミエリンはコレステロールと伴に細胞膜上で集合しミクロドメインを形成することがわかってきた。現在、このミクロドメインは脂質ラフトと呼ばれ、様々なシグナル伝達分子を会合させることにより膜を介するシグナル伝達の中継点として働いていることが明らかになってきた(笠原ら 蛋白質核酸酵素43, 2522-2530, 1998)。本研究で同定したスフィンゴ糖脂質会合タンパク質はすべて、ショ糖密度勾配遠心法によって分離できる脂質ラフト画分に回収されたことから、小脳顆粒神経細胞の脂質ラフトに局在していると考えられた(図2)。抗スフィンゴ糖脂質抗体による免疫沈降で、脂質ラフトに相当する構造体が沈降したと思われる。
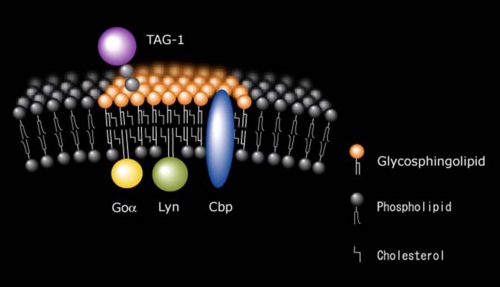
図2: スフィンゴ糖脂質会合タンパク質の脂質ラフト局在モデル
SrcファミリーチロシンキナーゼLyn 詳しくはこちら
非受容体型チロシンキナーゼであるLynは、パルミトイル化ミリストイル化によってラフトに結合していると考えられている。神経系においては小脳顆粒神経細胞に発現しているが、その機能はよくわかっていなかった。そこで初代培養小脳顆粒神経細胞に抗ガングリオシドGD3抗体を添加してみたところ、1分をピークとする一過性のLynの活性化とタンパク質チロシンリン酸化およびMAPキナーゼの活性化が検出された[Kasahara et al. J.Biol.Chem. 272 29947-29953 (1997)]。これはガングリオシドGD3がLynと単に物理的に結合しているだけでなく、機能的にカップリングしていることを示している。このことからガングリオシドGD3が細胞外からの何らかの刺激をLynに伝達する場を提供している可能性が考えられた。
Csk-binding protein Cbp 詳しくはこちら
パルミトイル化脂質ラフト膜貫通タンパク質であるCbpは、srcファミリーチロシンキナーゼの基質であることが知られ、実際にCbpがLynによってリン酸化されることを確かめた。srcファミリーチロシンキナーゼによって314番目のチロシン残基がリン酸化されると、リン酸化チロシンとSH2領域の相互作用によりsrcファミリーチロシンキナーゼの負の制御因子であるCsk(srcファミリーチロシンキナーゼのC末端をリン酸化することにより不活性化させる酵素)を細胞質から脂質ラフトに移行させsrcファミリーチロシンキナーゼの活性化を抑制することが知られている。初代培養小脳顆粒神経細胞を抗ガングリオシドGD3抗体で刺激するとCbpの314番目のチロシン残基がリン酸化され。実際に生体内でこのシグナル伝達がいつおこっているのかを解析したところ、発生初期の小脳でLyn活性化、Cbpの314チロシン残基リン酸化、Cskのラフト移行、Lyn 508チロシン残基リン酸化がラフト画分で検出された[Sekino-Suzuki et al. J.Neurochem. 124 514-522 (2013) :本論文はEditorial Highlightとして紹介された Sonnino et al. J.Neurochem. 124 432-435 (2013)](図3)。詳しくはこちら
小脳顆粒神経細胞は発生初期において、外顆粒層で増殖し、内顆粒層への移動することが知られているが、Lyn/Cbpのシグナル伝達が関わっている可能性が考えられた。
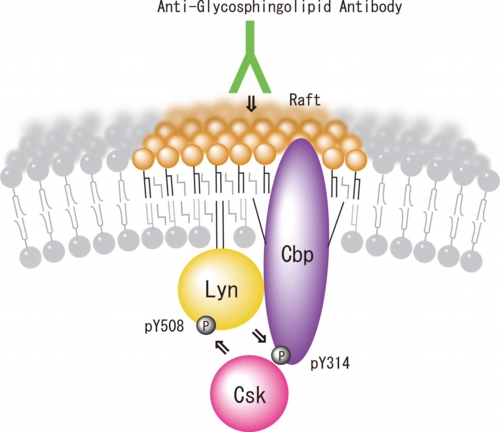
図3: 小脳顆粒神経細胞ラフトにおけるLyn/Cbpシグナル伝達モデル
小脳顆粒神経細胞表面のガングリオシドGD3に抗GD3抗体が結合するとLyn活性化、Cbpの314チロシン残基リン酸化がおこるメカニズムについては、図4に示すモデルを考えている。未刺激時にはLyn分子は活性の低い状態で離れて存在しているが、抗GD3抗体が結合すると脂質ラフトが融合する。するとLyn分子どうしが接近し互いに416番目のチロシン残基をリン酸化(Transphosphorylation)することにより活性の高い状態になる。そして脂質ラフトに存在する基質タンパク質Cbpがリン酸化される。
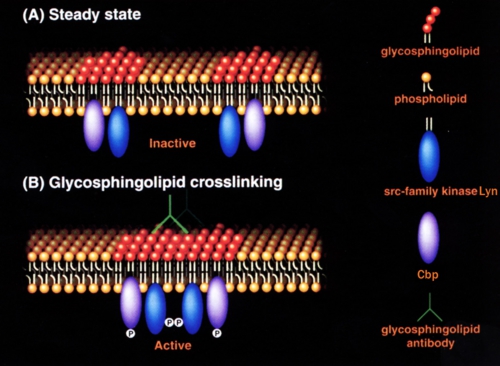
図4: 抗スフィンゴ糖脂質抗体結合によるLyn活性化モデル
GPIアンカー神経細胞接着分子TAG-1 詳しくはこちら
TAG-1は神経突起伸長活性を持つ免疫グロブリンスーパーファミリーに属するGPIアンカー神経細胞接着分子で、発生初期の小脳顆粒神経細胞に強く発現している。膜貫通領域を持たないTAG-1が細胞内にシグナルを伝えるメカニズムは不明であったが、小脳顆粒神経細胞表面のTAG-1を抗体でクロスリンクするとLynが活性化したことから、TAG-1がLynにシグナルを伝達していることがわかった[Kasahara et al. J.Biol.Chem. 275 34701-34709 (2000)](図5)。さらにTAG-1、Lyn、CbpおよびガングリオシドGD3はすべて成長円錐画分に濃縮していたことから、TAG-1によるシグナル伝達は小脳顆粒神経細胞の成長円錐ラフトでおこっていることがわかった。最近TAG-1欠損マウスが小脳顆粒神経細胞の内顆粒層への移動に異常をきたすことが報告された。これらのことから、小脳顆粒神経細胞の発生初期における細胞移動に、TAG-1/Lyn/CbpのガングリオシドGD3ラフトにおけるシグナル伝達が関わっているものと考えられた。
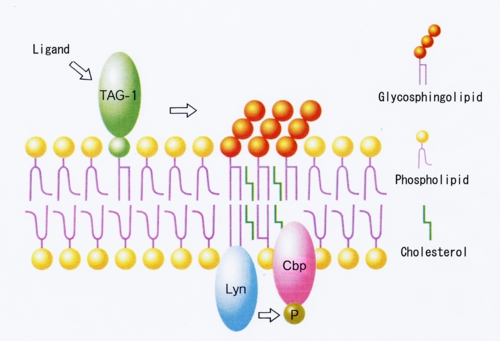
図5: TAG-1の小脳顆粒神経細胞ラフトにおけるLyn/Cbpを介するシグナル伝達モデル
三量体Gタンパク質Goαサブユニット 詳しくはこちら
三量体Gタンパク質は、αβγのサブユニットから成り、細胞表面のGタンパク質共役受容体から細胞内の効果器にシグナルを伝える分子スイッチとして働いている。刺激のない状態においては、αサブユニットはGDPと結合しており三量体Gタンパク質は活性を持たない。活性化した受容体から刺激を受けると、αサブユニットに結合しているGDPが離れてそこにGTPが結合する。この交換によって三量体はαサブユニットとβγ複合体の2つの成分に解離する。
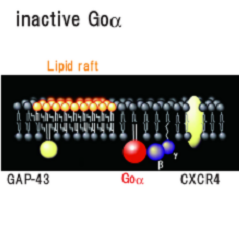
ラット初代培養小脳顆粒神経細胞において三量体Gタンパク質Goをマストパラン(スズメバチ毒素ペプチド)または非水解GTPアナログ(GTPγS)で活性化するとαサブユニットのみが脂質ラフト画分に移行することを見出し、実際に小脳の発生初期で活性化にともなう脂質ラフト画分への移行がおこっていることを示した[Yuyama et al. J.Biol.Chem. 282 26392-26400 (2007)]。そこで何が生体内でこの反応をおこしているかを検討したところ、Gタンパク質共役7回膜貫通型受容体CXCR4の生理的リガンドであるSDF-1αで同じ反応を示すことを見つけた(図6)。CXCR4が発現している小脳顆粒神経細胞をSDF-1αで処理すると、CXCR4およびGタンパク質βγサブユニットは非ラフト画分に残るが、GoαはGTPγS結合活性が上昇し(活性化し)、脂質ラフト画分(図6の白色膜領域)へ移行した。そしてGoαは成長円錐画分に濃縮していたことから成長円錐の観察をおこなったところ、SDF-1αまたはマストパランで処理すると成長円錐退縮がおき、百日咳毒素前処理でそれが阻害されることがわかった。試験管内における成長円錐退縮という現象は、生体内における反発分子による成長円錐誘導を反映するものであることが知られている。さらにSDF-1αまたはCXCR4欠損マウスで、小脳顆粒神経細胞移動と小脳顆粒層形成の不全がおこることが報告されている。よってSDF-1αによるGoαの脂質ラフトへの移行は、小脳顆粒神経細胞の軸索伸長に伴う神経細胞移動に関与していると考えられた。
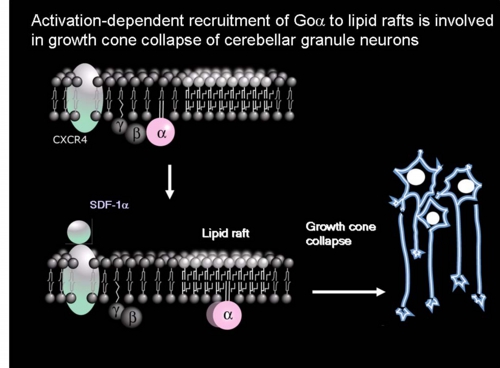
図6: Goαの脂質ラフト移行モデル
以上のことから、ガングリオシドGD3は発生初期小脳顆粒神経細胞の成長円錐ラフトにおいて神経突起調節分子を集積させ、そのシグナル伝達の場を提供していると結論した。
フォスファカンはTAG-1/GD3ラフトに依存する小脳顆粒細胞の反発因子として働く
細胞膜研究室の小松谷啓介研究員、笠原浩二研究室長らと、長岡技術科学大学の霜田靖准教授、鹿児島大学の武田泰生教授、東京理科大学の下仲基之教授、愛知医科大学の杉浦信夫客員研究員、神経回路形成プロジェクト前田信明リーダーらとの共同研究グループは、コンドロイチン硫酸プロテオグリカンであるフォスファカンが小脳顆粒細胞の反発因子として働く仕組みについて解明しました。
コンドロイチン硫酸プロテオグリカンであるフォスファカンは、小脳顆粒細胞の反発因子として働くことをこれまでに報告しましたが、その反発機構は不明でした。フォスファカンは、軸索伸長や細胞移動活性を持つGPIアンカー型神経細胞接着分子TAG-1とin vitroの系でコンドロイチン硫酸依存的に相互作用することが知られていたことから、TAG-1欠損マウスの小脳顆粒細胞に対するフォスファカンの反発を解析しました。すると反発作用がほとんどなかったことから、TAG-1はフォスファカンの受容体として働いていると考えられました。表面プラズモン共鳴解析によりTAG-1と相互作用するのはフォスファカンのコンドロイチン硫酸の一つであるCSC(コンドロイチン6硫酸)であることが分かりました。顆粒細胞は生後1日目から20日目にかけて外顆粒層で増殖、分子層、プルキンエ細胞層を通りぬけ内顆粒層に移動します。生後1日から11日までTAG-1は一過性に外顆粒層の顆粒細胞にのみ局在し、フォスファカンは隣接する分子層から内顆粒層にかけて存在し、TAG-1染色と接していました。顆粒細胞の外顆粒層から内顆粒層への移動は、内顆粒層に局在するBDNF(Brain-derived neurotrophic factor)による誘因作用によると考えられています。そこでBoyden chamberを使った細胞移動実験系で、BDNFによる顆粒細胞の移動がフォスファカンおよびCSCで抑制されることを見出しました。我々はこれまでに、フォスファカンが小脳顆粒細胞のGD3ラフトにおいてTAG-1を介するシグナルを伝達していることを報告してきました。これらのことから、フォスファカンのTAG-1/GD3ラフトを介する反発作用により顆粒細胞の外顆粒層からの移動が妨げられ、TAG-1の消失に伴い移動が可能になると考えられました。

用語解説
コンドロイチン硫酸プロテオグリカン
グルクロン酸とNアセチルガラクトサミンの二糖ユニットが繰返した糖鎖であるコンドロイチン硫酸とコアタンパク質が共有結合したハイブリッド分子。分子間相互作用を介して細胞外マトリックスを構成して、神経系においては軸索ガイダンスの調節因子として働く。
病気と脂質ラフトとの関わり
スフィンゴ糖脂質は様々な病気に関わる分子と会合することが知られている。細菌毒素(病原性大腸菌O-157が出すベロ毒素やコレラ菌が出すコレラ毒素など)やウイルス(エイズウイルス、インフルエンザウイルスやC型肝炎ウイルス)などの身体の外から侵入するもの、そしてアルツハイマー病を引き起こすアミロイドβタンパク質やギラン・バレー症候群をはじめとする自己免疫疾患で作られてしまう抗スフィンゴ糖脂質抗体などの身体の中でできてしまうものがある。これらの疾患関連分子の会合が脂質ラフトの集合状態や安定性に何らかの影響を及ぼすことが予想される。上記の病気の発症機構についてはまだ不明な部分が多いが、「脂質ラフトにおけるシグナル伝達異常」が原因となって重篤な病態を引き起こしている可能性が考えられる。実際にこれらの分子を結合させたときに脂質ラフトシグナルに何等かの変化が生じるかどうかを解析することにより、その可能性を検討していきたい。現在、脳神経以外の系においてもスフィンゴ糖脂質会合タンパク質の単離同定を試みている。
研究テーマ2: 血小板ラフト機能 詳しくはこちら
止血血栓の形成には血小板膜上における血液凝固因子の活性化が必要である。また、血液が凝固したのちに凝血塊が収縮する血餅退縮という現象が知られ、形成した血栓を強固にして止血を完全にする働きをすると考えられている。従来、血小板は活性化によりリン脂質のフリップにより血液凝固因子に活性化の場を提供するとされてきた。近年、糖脂質ミクロドメインである脂質ラフトが、様々な細胞の活性化のシグナル伝達に関与していることが明らかとなり注目されている。しかし血小板機能との関係についてはよくわかっていない。そこで本研究で私たちは、血小板活性化に伴い脂質ラフトに移行する血液凝固因子の存在の可能性を検討したところ、フィブリンが特異的にスフィンゴミエリンから成る脂質ラフトに移行することを見出した。さらにフィブリン脂質ラフト移行の生理的意義、特に血餅退縮における役割について解析を試みた。
ヒト洗浄血小板をトロンビンで活性化後、ショ糖密度勾配遠心にてラフト画分(フラクション4-6)、非ラフト分画(フラクション7-10)を調製した。ラフト分画に存在するタンパク質を電気泳動にて分離後、質量分析装置によって同定した。トランスグルタミナーゼである活性化XIII因子によるフィブリンγ鎖の架橋部位のグルタミンをアラニンに置換したヒト成長ホルモンとの融合タンパク質を作製し、脂質ラフトへの移行を調べた。血餅退縮は、platelet-rich plasmaにトロンビンを添加し形成されたclotが経時的に収縮する様子をデジタルカメラで撮影し、面積比を計測した。
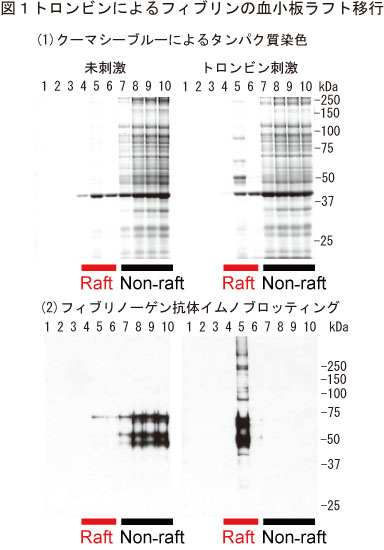
(A) 洗浄血小板のトロンビン刺激によるフィブリンの脂質ラフト移行
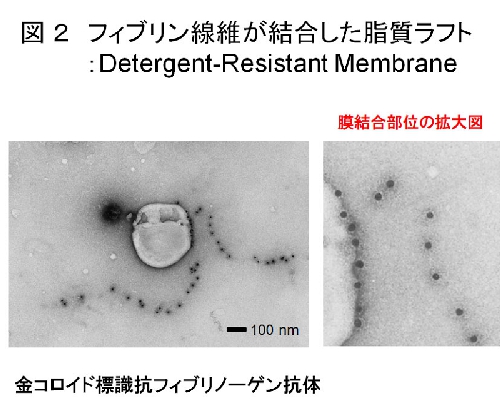
ヒト洗浄血小板をトロンビン刺激すると分子量67,52,47kDaの主要タンパク質が脂質ラフト画分(ショ糖密度勾配遠心)に検出された(図1)。質量分析によりその同定を試みたところ、それぞれフィブリンのα,β,γ鎖であることがわかった。そしてフィブリノーゲン/フィブリン抗体を使ったイムノブロッティング法によって、未刺激時にはフィブリノーゲンとして非ラフト画分に存在し、30秒間のトロンビン刺激によってフィブリンになりラフト画分に移行することを確かめた。またトロンビン刺激血小板においてフィブリンが、ライセニン陽性のスフィンゴミエリンラフトと共局在した。さらに実際にフィブリンがトロンビン刺激血小板の脂質ラフトに結合しているかどうかを免疫電顕法により解析したところ、脂質ラフト画分の膜にフィブリン線維が直接結合していることが観察された(図2)。
(B) 血液凝固XIII因子に依存するフィブリン脂質ラフト移行の血餅退縮への関与
ヒト洗浄血小板をトロンビン受容体アゴニストであるThrombin receptor-activating peptideで刺激しただけではラフト移行はおこらなかったことから、トロンビンによって活性化する因子の関与の可能性が示唆された。血液凝固XIII因子はトロンビンにより活性化されるトランスグルタミナーゼであり、活性化XIII因子によるフィブリンγ鎖の架橋部位Q398Q399をA398A399に変異させるとラフトへの移行は阻害された。またトランスグルタミナーゼ阻害剤であるシスタミンは、フィブリンの脂質ラフト移行および血餅退縮を抑制した。この結果から、血小板α顆粒中に存在しているフィブリノーゲンが、トロンビンにより放出され、フィブリンに変換され血小板表面に結合し、XIII因子のトランスグルタミナーゼ活性により脂質ラフトに移行したと考えられた。また血餅退縮はフィブリン受容体GPIIb/IIIa(インテグリンαIIbβ3 )の細胞質側にミオシンが結合しアクトミオシン系の収縮によっておこると考えられているが、トロンビン刺激で脂質ラフトにおいてミオシン量が増加したことから、細胞外のフィブリン線維と細胞内のアクトミオシン系が脂質ラフトを介して連結し、血餅退縮を引き起こしているという仮説を立てた。最近XIII因子Aサブユニット欠損マウスにおいて血餅退縮が欠如することを報告し[Kasahara K., Souri, M., Kaneda, M., Miki, T., Yamamoto, N., Ichinose, A. Impaired clot retraction in factor XIII A subunit-deficient mice. Blood 115, 1277-1279 (2010)]詳しくはこちら、仮説が支持された。そして本研究においてXIII因子Aサブユニット欠損血小板におけるトロンビン刺激によるフィブリンのラフト移行を解析したところ、ラフト移行も抑制されることが確かめられた。
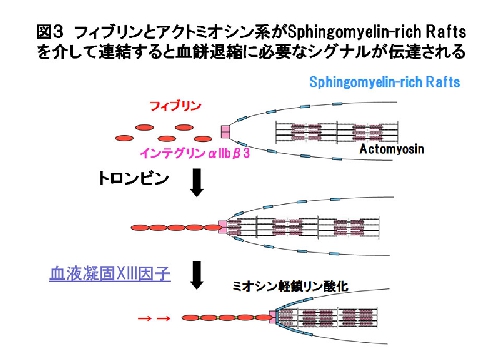
トロンビン刺激によりフィブリノーゲンがα顆粒から放出されインテグリンαIIbβ3 に結合しフィブリンに変換され、活性化血液凝固第XIII因子によってスフィンゴミエリンラフトが集積し、細胞内のアクトミオシン系と連結することにより血餅退縮に必要なシグナル伝達がおこると考えられた[Kasahara et al. Blood 122, 3340-3348 (2013)](図3)。スフィンゴミエリンを標的とした新しい血栓症治療法の開発につながることが期待される。本研究はINSIDE BLOOD欄で紹介されました[Munday et al. Blood 122, 3246-3247 (2013)]。詳しくはこちら
研究テーマ3 : ガラクトシルセラミドGalCer発現因子GEF-1の機能 詳しくはこちら
糖脂質GalCer発現因子GEF-1を標的とするがん腫瘍の増殖抑制剤の開発 (担当:小倉潔研究員)
GEF-1(HGS)を分子標的とした新規増殖抑制法の基礎研究を進めている。GEF-1の発現抑制法(shRNA法、および、siRNA法)やGEF-1のC領域蛋白(GEF-1/C)発現により、マウス及びヒト由来のがん腫瘍の増殖を抑制できることを明らかにした。さらに、腫瘍抑制剤の開発を目的としたGEF-1/C構成オリゴペプチドによるがん腫瘍増殖抑制効果を検証した。GEF-1/Cを構成する数種類のオリゴペプチドは、in vitro系・in vivo系において、マウスB16細胞、ヒト難治性肺がん細胞A549細胞、膵がん細胞PT45細胞、大腸がん細胞COLO205細胞の腫瘍増殖を抑制した(図)。
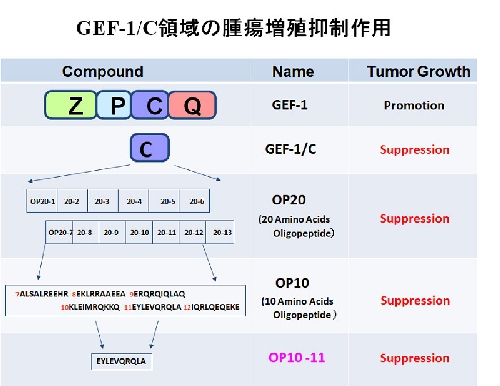
小倉 潔:「HGF-regulated tyrosine kinase substrate (HGS)を標的とした新規腫瘍増殖抑制剤」
特願2018-160501, 2018. 8. 29
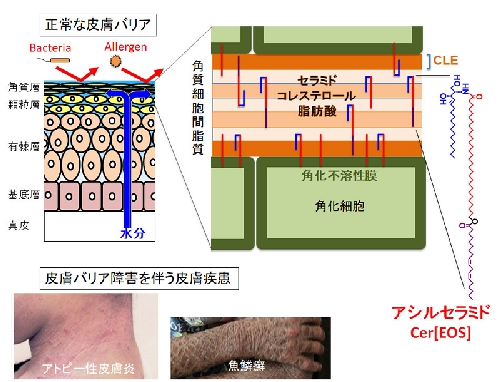
アシルセラミド代謝酵素 (担当:平林哲也主席研究員)
皮膚の最外層である角層は、外界からの異物侵入や肌水分の喪失を防ぐバリア機能を備えており、これらの機能が障害されると魚鱗癬、ドライスキン、アトピー性皮膚炎などの要因となります。角層のバリア機能には脂質代謝が重要であり、中でも表皮特有に存在するアシルセラミド(ω-O-acylceramide、Cer[EOS]とも呼ばれる)の代謝は水分透過性バリアの形成において中心的な役割を果たします。なぜなら、アシルセラミドは角質細胞間脂質のラメラ構造の形成・維持に不可欠な脂質成分であるとともに、リノール酸部分が複雑な過程で酸化された後に角化不溶性膜(周辺帯)と共有結合し、CLE(corneocyte lipid envelope)と呼ばれる非常に重要な1層の脂質層を形成する際の原料として利用されるからです(図)。アシルセラミドの化学構造は、スフィンゴシン骨格(図の右端のアシルセラミドの化学構造式の青色部分)に酸アミド結合する脂肪酸の鎖長が炭素数30〜38程度と極端に長いこと(構造式の赤色部分)、さらにその先端(ω末端と呼ぶ)にリノール酸(炭素数18、不飽和結合数2のω-6必須脂肪酸)がエステル結合している(構造式の紫色部分)という特徴があります。このような極めて特殊な化学構造にはどのような意味があるのでしょうか?
我々はこれまでに、それぞれ常染色体劣性先天性魚鱗癬(ARCI)10と13の原因遺伝子であるPNPLA1(patatin-like phospholipase domain containing 1)とSDR9C7(short chain dehydrogenase /reductase family 9c member 7)の機能解析を遺伝子改変マウスの利用により進めてきました。その結果、PNPLA1はセラミドのω末端にリノール酸を特異的に転移するアシルセラミド合成酵素であること [Hirabayashi et al. Nat. Commn. 8, 14609 (2017)]、SDR9C7はアシルセラミドのリノール酸部分の13位にリポキシゲナーゼ反応で導入された水酸基(-OH)をケトン基(=O)に脱水素化し、それによって生じるエポキシケトン型アシルセラミドがCLE形成に不可欠であること[Takeich, Hirabayashi et al. J. Clin. Invest. 130, 890-903 (2020)]などを明らかにしてきました。これらの成果により、アシルセラミドに含まれるリノール酸部分がどのように結合するのか、あるいはなぜリノール酸でなければならないのかといった疑問の一部に答えを出すことができました。しかしながら、CLEの化学構造や形成メカニズムをはじめ、バリア機能に関わる脂質代謝には不明な点がまだ多く残っており、それらを一つずつ解明していくことで、バリア障害を伴う皮膚疾患のより深い理解や治療法の開発などに貢献できると考えています。
研究テーマ5: 脂質代謝酵素の機能解析
肝臓の細胞膜から重要な栄養素コリンを取り出す仕組みを発見
(担当:平林哲也主席研究員)
細胞膜研究室の平林哲也主席研究員、東京大学大学院医学系研究科 疾患生命工学センターの村上誠教授らの研究グループは、慶應義塾大学、昭和大学などと共同で、「肝臓のリン脂質に貯蔵されるコリンを取り出す新たな代謝経路」を発見しました。コリン[1]は、発育、肝機能、認知機能、中性脂質の輸送などに重要な栄養素であり、肝臓において必須アミノ酸のメチオニンの再生にも利用されます。本研究成果は、コリンを体内でリサイクルする仕組みとその意義を解明した画期的な成果であることから、米国の医学・生物学を扱うセル出版(Cell Press)が発行する学術雑誌『Cell Reports(セル・リポーツ)』のオンライン版に2023年1月30日(米国東部時間)に先行公開されました。
<論文名>
“Hepatic Phosphatidylcholine Catabolism Driven by PNPLA7 and PNPLA8 Supplies Endogenous Choline to Replenish the Methionine Cycle with Methyl Groups”
(PNPLA7とPNPLA8による肝臓のホスファチジルコリンの異化(分解)作用は、内因性コリンを供給し、メチオニン回路のメチル基の補充に利用される)
<著者>
Tetsuya Hirabayashi#*, Mai Kawaguchi#, Sayaka Harada#, Misa Mouri, Rina Takamiya, Yoshimi Miki, Hiroyasu Sato, Yoshitaka Taketomi, Kohei Yokoyama, Tetsuyuki Kobayashi, Suzumi M. Tokuoka, Yoshihiro Kita, Emiko Yoda, Shuntaro Hara, Kyohei Mikami, Yasumasa Nishito, Norihito Kikuchi, Rieko Nakata, Mari Kaneko, Hiroshi Kiyonari, Kohji Kasahara, Toshiki Aiba, Kazutaka Ikeda, Tomoyoshi Soga, Makoto Kurano, Yutaka Yatomi, and Makoto Murakami*
#共同筆頭著者、*責任著者
<発表雑誌>
Cell Reports(セル・リポーツ)
DOI: https://doi.org/10.1016/j.celrep.2022.111940
<研究の背景>
コリンは体にとって非常に大切な栄養素であり、細胞膜、神経伝達物質などの合成に利用されます。さらには肝臓では、コリンに含まれるメチル基を利用して、必須アミノ酸であるメチオニンを再生する回路(メチオニン回路[2])が備わっており(図1)、コリンはメチル基の重要な供給源でもあります。また、コリンが不足すると中性脂質が肝臓に蓄積して脂肪肝になることも知られています。このように、コリンは、認知機能、肝機能、中性脂質の輸送などに重要な栄養素であることから、コリンやメチオニンは、家畜の飼料をはじめ、一部の粉ミルクやペットフードにも添加・配合されています。また、欧米やアジアではコリン摂取量の目安を設定する国が増えており、米国では必須栄養素として指定されています。一方で、高濃度のコリンは有害であるため、その濃度は低く保たれており、生体内に存在するコリンの95%以上は細胞膜の主要構成要素であるホスファチジルコリン[3]と呼ばれるリン脂質に貯蔵されています。しかしながら、この細胞膜に貯蔵されたコリンを取り出す酵素の正体はこれまでよく分かっていませんでした。
<研究の概要>
肝臓では、ホスファチジルコリンからコリンを取り出す際に、ホスファチジルコリン→リゾホスファチジルコリン[4]→グリセロホスホコリン[5]→コリン(リン脂質分解経路)という順序で分解が進むことが、以前の研究から予想されていました(図1)。ホスファチジルコリンやリゾホスファチジルコリンを分解する酵素には様々なタイプが知られていますが、研究グループは、その中でもホスホリパーゼA2と呼ばれる脂質代謝酵素群の研究を長年にわたって行ってきました。候補酵素群の遺伝子を欠損する様々なマウスを網羅的に解析した結果、PNPLA7やPNPLA8を持たないマウスの肝臓で、水溶性のグリセロホスホコリンの量が大きく減少しており、それに伴って遊離コリンの量も減少していました(図2)。さらにはコリンが肝臓のミトコンドリアで酸化されてできるベタイン[6]や、メチオニンから合成されるS-アデノシルメチオニン[7]と呼ばれるメチル化反応[8]に不可欠な化合物も、PNPLA7やPNPLA8の欠損マウスの肝臓では有意に減少していました(図2)。これらの欠損マウスは、成長不良、体脂肪の減少、肝臓から分泌されるリポタンパク質[9]と中性脂質の減少、血糖値の低下などをはじめとした、コリンやメチオニンの欠乏症によく似た特徴を示しました(図2)。さらに、上述のリン脂質分解経路の中で、PNPLA8は第1段階(ホスファチジルコリン→リゾホスファチジルコリン)、PNPLA7は第2段階(リゾホスファチジルコリン→グリセロホスホコリン)の反応に関わることがわかりました。これらの結果から、PNPLA8とPNPLA7によるリン脂質分解反応は、細胞膜のホスファチジルコリンの中に蓄えられたコリンを水溶性のグリセロホスホコリンとして取り出す役割を持ち、さらにこのグリセロホスホコリンがコリンとグリセロール3-リン酸に分解されて、前者はメチオニン回路へのメチル基の供給に利用され、後者は中性脂質のトリグリセリドの合成や糖の新生に利用されることが明らかとなりました。
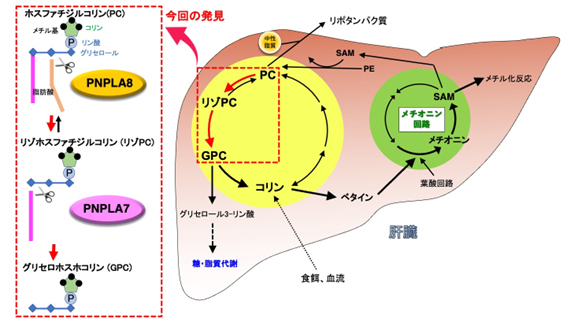
図1 肝臓におけるコリン・メチオニン代謝
肝臓では細胞膜の主要構成成分であるホスファチジルコリン(PC)にコリンが大量に貯蔵されているが、PCを分解してコリンを取り出す酵素群はこれまで見つかっていなかった。本研究により、PCに2つ結合する脂肪酸のうちの1つがホスホリパーゼA2[10]活性を持つPNPLA8によって切り取られてリゾPCとなり、さらにもう一つの脂肪酸がリゾホスホリパーゼ[11]活性を持つPNPLA7によって切り取られてグリセロホスホコリン(GPC)となることが、それぞれの酵素を欠損するマウスの解析により明らかとなった。GPCはコリンとグリセロール3-リン酸[12]に分解され、コリンはさらにベタインに変換されてメチオニン回路にメチル基を供給するのに役立つ。
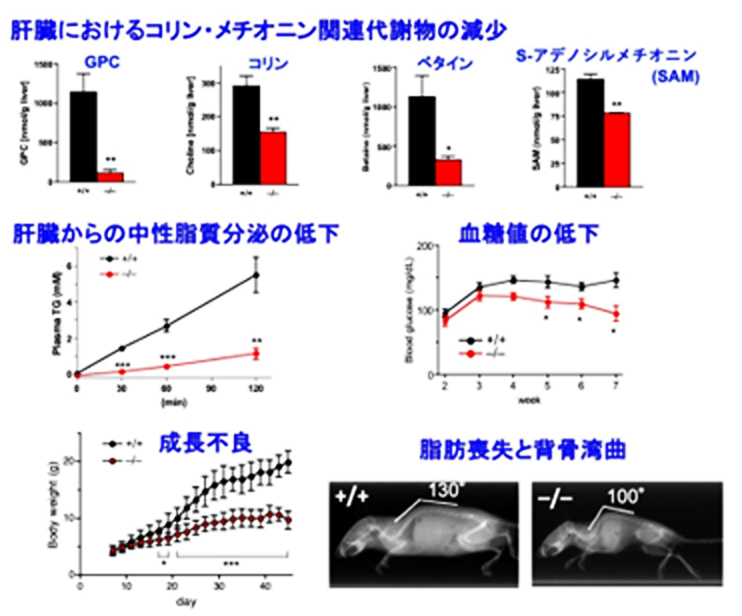
図2 全身性Pnpla7欠損マウスの主な表現型
(上段)PNPLA7をコードする遺伝子を欠損したマウス(–/–.赤)は、6週齢の肝臓に含まれるグリセロホスホコリン(GPC)、コリン、ベタイン、S-アデノシルメチオニン(SAM)などのコリン・メチオニン関連代謝物の量が、野生型(+/+.黒)と比べて減少していた。
(中段)この欠損マウスでは肝臓からのリポタンパク質を介した中性脂質(トリグリセリド)の分泌の低下、血糖値の低下などが見られた。
(下段)この欠損マウスは、成長不良、脂肪組織の縮小、背骨の彎曲などの表現型を示した。
これらの変化に関しては、PNPLA8を欠損したマウスでも同様の傾向が見られた。
*p<0.05, **p<0.01, *** p<0.001
<今後の展望>
今回の研究により、PNPLA7とPNPLA8という2つの酵素が肝臓の細胞膜に蓄えられたコリンを取り出す役割を担うことを初めて明らかにしました。この経路はメチル基の供給や、肝臓での中性脂質の合成・分泌のみならず、成長、血糖値、体脂肪量などにも関与することが示されました。本研究の成果により、コリンやメチル基の不足によって起きる疾患の病態解明と、これらの脂質分解酵素を標的とした新規治療法の開発が期待されます。
脂質ラフトとは何か?
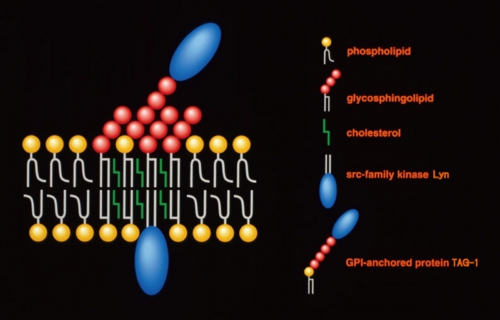
脂質ラフト
脂質ラフト(Lipid rafts)は、スフィンゴ糖脂質、スフィンゴミエリン、コレステロールに富む細胞膜上に存在すると考えられているミクロドメインである。様々なシグナル伝達分子を結合させることにより、細胞膜を介するシグナル伝達の中継点として働き、多くの生命現象を調節している。
構造
スフィンゴ糖脂質とスフィンゴミエリンは飽和脂肪酸を持っていることが多く、分子が直線状であり脂質二重層内で密に会合できる。一方、生体内のグリセロリン脂質はシス不飽和脂肪酸を持っていることが多く、分子が折れ曲がっていて脂質二重層内で密に会合できない。このことから一般的に脂質ラフトは脂質の性質の違いによりできる領域であると考えられている。コレステロールはスフィンゴ脂質と親和性が高く、スフィンゴ脂質の間にはさまれる形で存在するとされている。Srcファミリーチロシンキナーゼや三量体Gタンパク質はパルミトイル化やミリストイル化といった脂質ラフト脂質と似た性質の飽和脂肪酸による修飾を受けていることから、脂質ラフトに局在すると考えられている。また特異的な膜貫通タンパク質も脂質ラフトに局在していることから、脂質ラフトの形成には脂質間相互作用の他に脂質-タンパク質およびタンパク質間の相互作用も関与していると考えられている。しかし脂質ラフトの形成機構の詳細についてはまだ明らかにされておらず、スフィンゴ糖脂質の糖鎖間相互作用やレクチンとの結合により形成される可能性も指摘されている。
機能
Tリンパ球が抗原刺激により活性化する際に、脂質ラフトを介するシグナル伝達が必要であることがわかっている。抗原が抗原受容体に結合するとそこにガングリオシド(シアル酸を持つスフィンゴ糖脂質)GM1からなる脂質ラフトが集合し、その領域の細胞質側でSrcファミリーチロシンキナーゼをはじめいくつかのシグナル伝達分子が集合体をつくることにより、細胞の活性化に必要な効率の高いシグナル伝達を可能にしている。免疫系のみならず多くの細胞系において、接着移動や分化増殖といった現象に関与している。脂質ラフトは安定な構造体ではなく、刺激に応じて集合状態を変化させる。刺激を受けていない定常状態における脂質ラフトは1-20nmの大きさで1ミリ秒程度の寿命であるが、刺激を受けることにより大きく安定なラフトができる。また脂質ラフトは均一ではなく、分子組成の異なる脂質ラフトが存在し、それぞれ特異的な機能を果たしていると考えられている。Tリンパ球は遊走時、先導端の膜にはガングリオシドGM1特異的なラフトが局在し、細胞後方の尾部の膜にはガングリオシドGM3特異的なラフトが局在する。そして、それぞれに遊走に関わる異なる機能タンパク質が共局在している。

 MEMBER
MEMBER