Method メソッド
顕微鏡で組織構造を観察するためには、① 固定、② 包埋、③ 薄切、④ 染色の手順を踏みます。

① 固定
生体から取り除かれた組織はそのままでは分解酵素により蛋白質が変化して細胞構造が崩壊してしまいます。組織が生体内にあった状態と近い状態を保つための処理を「固定」といい、組織標本を作るために非常に重要です。研究においては組織の形態や蛋白質の抗原性の保持が固定の主な目的となります。
固定液
蛋白質に架橋を形成し組織を安定化させるアルデヒド系固定液(ホルマリン、パラホルムアルデヒド)が推奨されます。免疫染色では架橋形成によりエピトープがマスクされ、抗体と反応できない場合があるため抗原賦活の前処理が必要となります。
そのほかに脱水系固定液(アルコールやアセトン)や浸透力の高いピクリン酸を用いた固定液(ブアン液、ザンボニ液)などがあり目的に応じて使い分けます。
適切な固定を行うためには固定液のpH、浸透圧、温度や浸透時間等に留意しなければなりません。
固定方法
固定液を組織に浸透させる方法には灌流固定法と浸漬固定法があります。
灌流固定法
麻酔下の動物の血管系を通して固定液を流し臓器の深部から固定する方法です。ペリスタポンプやイルリガートルを用いて流速を調節し全身に固定液を流します。
 ペリスタポンプ
ペリスタポンプ
浸漬固定法
小さく切り出しした臓器を固定液に浸漬して組織を固定する方法です。組織の大きさに応じ十分量(10倍以上、多い分には構わない)の固定液で数時間〜24時間ほど浸漬します。大きい組織を固定する場合は切り込みを入れ固定液が浸透しやすくします。(4%パラホルムアルデヒド固定液の組織への浸透はおおよそ1mm/時間)
参考
長期保存する場合は固定液中での保存は避け、アジ化ナトリウムを加えた0.1M PBS に試料を移し4℃で保存する。
② 包埋
組織を薄くスライスするために、柔らかい組織を適度な硬さに必要があります。組織をブロック状に固める作業を「包埋」といいます。
包埋法
パラフィン包埋法
組織を溶けたパラフィン(ろうそくの原料)に埋め込み固める方法です。作成したブロックは安定しており、半永久的に組織の形態を保持できるという長所があります。
パラフィンは疎水性が高いためそのままでは組織中に浸透しません。パラフィンと溶け合う有機溶媒を介してパラフィンを浸透させる必要があり、脱水→中間剤処理→パラフィン浸透の3段階の工程で行います。当施設では各工程を自動処理できる自動包埋装置を使用しパラフィン包埋を行うことができます。
 自動包埋装置
自動包埋装置
※パラフィン包埋の前処理
脱脂:パラフィンの浸透を妨げる脂肪が多い組織(白色脂肪、乳腺など)の包埋を行う場合は前処理としてメタノール/クロロホルムなどで脂肪を溶出させる処理を行います。
脱灰:骨などの硬組織や石灰化した病巣がある組織は薄切が困難となるためキレート剤(EDTA)や酸(ギ酸、塩酸)などでカルシウムなどの石灰分を溶出させ軟化させる処理が必要となります。
パラフィン包埋法の工程
- 脱水
固定後の組織の水分を除去する工程です。70%〜100%まで段階的に希釈したエタノールで複数回処理し徐々に高濃度のエタノールに移していくことで水分をエタノールに置換します。 - 中間剤処理
パラフィンはエタノールとも交わらないためキシレンやクロロホルムなどの中間剤を複数回処理し脱エタノールを行います。 - パラフィン浸透
60℃前後の溶けたパラフィンに組織を移し置換させます。溶けたパラフィンで満たした包埋皿に組織を入れ冷やし固めます。


凍結包埋法
組織を水溶性の封入剤(O.C.Tコンパウンドなど)に包埋、凍結させ薄切用のブロックを作製する方法です。パラフィン包埋法と比較し短時間で作成できます。
包埋の処理工程で有機溶媒や加熱を必要としないため、脂肪染色を行う場合や抗原の反応性が失われにくいという利点があります。また未固定の組織でもブロックを作成することが可能なため免疫染色に適しています。
しかし氷晶の形成や保存に超低温槽が必要など形態保持に優れていない欠点があります。
凍結包埋法の工程
- スクロース置換
氷晶形成を防ぐため、10%, 20%, 30%と段階的にスクロール/PBS液に浸け置換していきます。試料がスクロール/PBS液に沈んだら次の濃度に移す目安になります。 -
凍結ブロック作成
包埋剤の入ったクリオモルドやアルミ皿にスクロース置換を行った試料を包埋し冷却溶媒(液体窒素、ドライアイスで冷やした有機溶媒)に沈め冷やし固めます。
その他、炭酸ガスを噴射し直接冷やし固める方法もあります。
③ 薄切
光が透過できるほど(μm単位)組織を薄く切る工程です。
パラフィンブロック
滑走式ミクロトームやロータリー(回転式)ミクロトームを使用し均一で薄い切片を切りスライドガラスに貼り付けていきます。
 滑走式ミクロトーム
滑走式ミクロトーム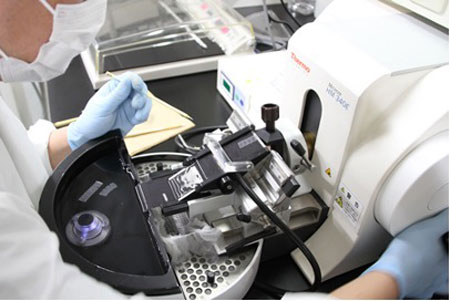 回転式ミクロトーム
回転式ミクロトーム
凍結ブロック
低温庫内で薄切をおこなうクリオスタットや凍結が可能な試料ステージをつけた滑走型ミクロトームなどの凍結ミクロトームで組織の薄切を行います。
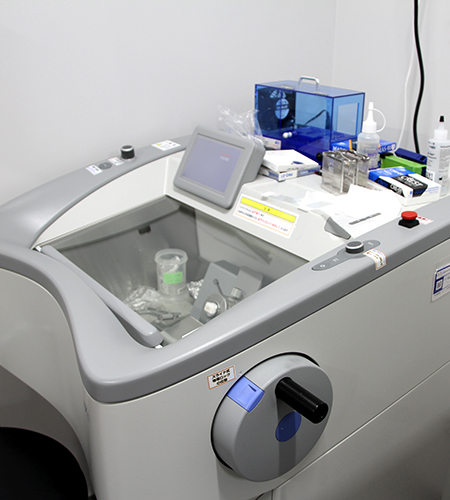 クリオスタット
クリオスタット 電子凍結ミクロトーム
電子凍結ミクロトーム 炭酸ガス凍結ミクロトーム
炭酸ガス凍結ミクロトーム
④ 染色
薄切した切片を観察しやすいように色素などで染色する工程です。
- 一般染色であるヘマトキシリン・エオジン(HE)染色を行い全体的は組織の構造や形態的変化を観察します。(ヘマトキシリン色素により核が青色に、エオジン色素により細胞質など核以外の構造が染色されます)
- 目的に応じ組織の特定の構造物を同定する特殊染色を行います。
- 特定の蛋白質やペプチドの組織内の局在を検出するため、特異的な抗体を用いた免疫染色を行います。目的物質を可視化するために酵素と発色基質を利用した酵素抗体法や蛍光物質を標識した抗体を利用する蛍光抗体法があります。
染色実績はこちらをご覧ください >>>
染色例 :小脳
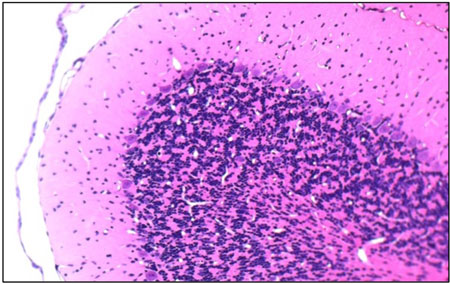 HE染色
HE染色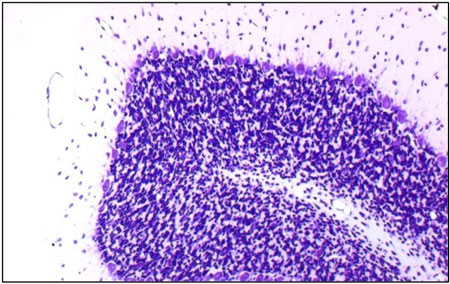 Nissl染色
Nissl染色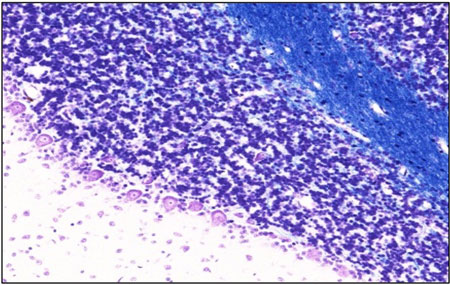 KB染色
KB染色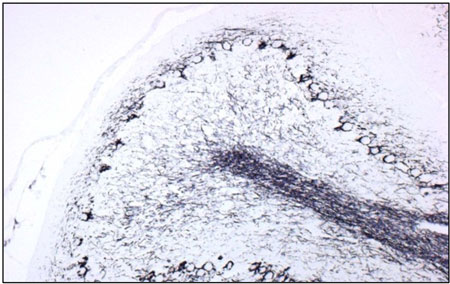 酵素抗体法(DAB)
酵素抗体法(DAB)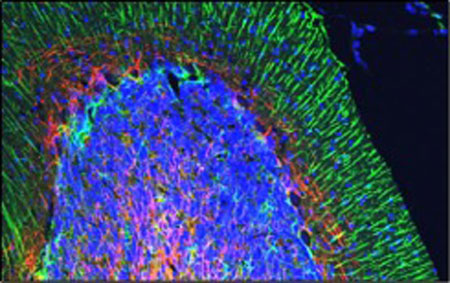 蛍光抗体法
蛍光抗体法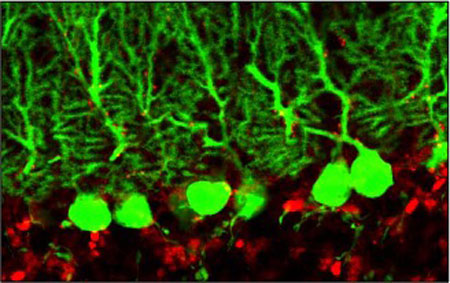 蛍光抗体法
蛍光抗体法



