これまでの主な研究成果Achievement
発表論文(大学院生の宮下、八木ら)2023年10月
K. Miyashita*, T. Yagi*, N. Kagaya, A. Takechi, C. Nakata, R. Kanda, H. Nuriya, K. Tanegashima, S. Hoyano, F. Seki, C. Yoshida, Y. Hachiro, T. Higashi, N. Kitada, T. Toya, T. Kobayashi, Y. Najima, S. Goyama, S. A. Maki, T. Kitamura, N. Doki, K. Shin-ya, and T. Hara. Identification of compounds that preferentially suppress the growth of T cell acute lymphoblastic leukemia-derived cells. Cancer Sci., 114: 4032-4040, 2023. *First two authors equally contributed to the work.
(内容紹介)急性Tリンパ芽球性白血病(T-ALL)は、小児の罹患率が高い予後不良の難治性がんであり、特効薬はまだ開発されてない。我々は、天然化合物ライブラリーの大規模スクリーニングによって、ヒトT-ALL細胞株CCRF-CEM(以下、CEM)を死滅させるが、ヒトBリンフォーマ細胞株Rajiの増殖に影響を与えない3種類の天然化合物を同定した。これらの内で、Auxarconjugatin BとRumbrinは共通の化学構造を有していた。そこで、合成展開研究をおこなって、Auxarconjugatin Bより優れたT-ALL選択性、高い抗がん活性を有する類縁体Ra#37の創出に成功した。Auxarconjugatin B とRa#37は、CEM細胞のミトコンドリアに集積し、ミトコンドリアの膜電位を急速に消失させることで細胞死を誘導した。本剤は、T-ALL治療薬開発のためのリード化合物として有用と期待される。
発表論文(北島健二 主席研究員ら)2022年8月*
K. Kitajima*, M. Shingai, H. Ando, M. Hamasaki, and T. Hara*. An interferon-γ/FLT3 axis positively regulates hemopoietic progenitor cell expansion from human pluripotent stem cells. Stem Cells, Published on line on July 28, 2022 as
doi.org/10.1093/stmcls/sxac052. *Co-corresponding authors.
(内容紹介)ヒトiPS細胞由来の胚様体をカルチャーインサートの上に置き、IL-3, SCF, Flt3Lを含む培地の上でオルガノイド形成させることで、CD45+CD34+Lineage–CD38–のヒト造血幹・前駆細胞(HSPCs)を効率よく分化誘導することに成功した。しかし、これらの細胞集団は、完全免疫不全NSGマウスへ移植した後のヒト造血系再建能が低かった。ヒトiPS細胞由来の血液細胞を詳しく解析したところ、骨髄や臍帯血のHSPCsは、通常、CD38+のHPCsを経て単球/マクロファージ・顆粒球などに分化するが、ヒトiPS細胞から作り出されたHSPCsは、CD38+ HPCsを経由せずに単球・顆粒球に直接分化していた。そこで、臍帯血由来HSPCsと遺伝子発現プロファイルを比較した結果、iPS細胞由来HSPCsでは受容体型チロシンキナーゼFLT3の発現レベルが極めて低いことがわかった。FLT3はHSPCsの増殖・生存に重要である。ヒトiPS細胞にFLT3を恒常的に発現させてから分化誘導してみたところ、HSPCs産生量が顕著に増加した。さらに、ヒトiPS細胞をIFN-γで刺激すると、FLT3の発現抑制が解除されてHSPCsの分化誘導が促進されることも判明した。以上の実験結果は、ヒトiPS細胞からHSPCsを試験管内分化誘導する際に考慮すべき点と解決法を示唆している。
* 詳細は医学研トップページのTOPICS2022の中に掲載されていますので、ご覧下さい。
発表論文(種子島幸祐 主席研究員ら)2022年6月*
K. Tsujihana*, K. Tanegashima*, Y. Santo, H. Yamada, S. Akazawa, R. Nakao, K. Tominaga, R. Saito, Y. Nishito, R. Hata, T. Nakamura, I. Murai, Y. Kono, M. Sugawa, M. Tanioka, G. Egawa, M. Doi, T. Isa, K. Kabashima, T. Hara**, and H. Okamura**. Circadian protection against bacterial skin infection by epidermal CXCL14-mediated innate immunity. Proc. Natl. Acad. Sci. U.S.A., 119: e2116027119, 2022.
(doi.org/10.1073/pnas.2116027119)
*Equally contributed authors, **Co-corresponding authors.
(内容紹介)皮膚は環境から個体を守る最外層の構造で、異物の侵入から身を守る最前線として働いている。しかし、皮膚の免疫機能はまだ十分に解明されていない。京都大学の岡村均研究室は、足底のマウス表皮組織に着目し、レーザーマイクロダイセクション法によりさまざまな時間で切り出し、遺伝子発現を網羅的に解析した。その結果、ケモカインCXCL14が生体リズムに沿った著明な発現変動を示すことを見出した。我々は、免疫系におけるCXCL14の機能と作用メカニズムを長年研究してきたので、数年前から皮膚のCXCL14の役割を解明する共同研究を開始した。皮膚表面の悪玉菌として知られる黄色ブドウ球菌をマウスの耳に接種して増殖率を調べたところ、CXCL14の発現が高い昼の間は菌の増殖が強く抑えられていたが、発現が低くなる夜では菌の増殖が盛んになった。CXCL14欠損マウスの皮膚では菌の増殖は、一日中盛んなままであった。黄色ブドウ球菌由来のDNAはCXCL14に強く結合し、皮膚でのTLR9を介する自然免疫反応を増強した。興味深いことに、夜行性のマウスではCXCL14の発現が昼は高く夜は低かったのに対し、ヒトと同じ昼行性の霊長類であるコモンマーモセットでは、昼は低く夜は高くなっていた。CXCL14は休眠期において表皮細胞から分泌され、表皮に侵入した細菌のDNAに結合し、それを樹状細胞に運び入れている。その結果、TLR9を介した自然免疫系が活性化され、黄色ブドウ球菌のような病原体の過剰増殖から皮膚が保護されているものと推察される。
* 詳細は医学研トップページのTOPICS2022の中に掲載されていますので、ご覧下さい。
発表論文(岩瀬璃奈 大学院生、種子島幸祐 主席研究員ら)2021年7月*
R. Iwase, N. Naruse, M. Nakagawa, R. Saito, A. Shigenaga, A. Otaka, T. Hara, and K. Tanegashima. Identification of functional domains of CXCL14 involved in high-affinity binding and intracellular transport of CpG DNA. J. Immunol, 207: 459-469, 2021.
doi:10.4049/jimmunol.2100030.
(内容紹介)2017年に我々は、ケモカインCXCL14が細菌に多い非メチル化CpG DNAと高親和性で結合し、それを樹状細胞内に運び入れることでTLR9を介した自然免疫反応を増強することを発見した。しかし、この機能がCXCL14特有の性質なのか、そしてCXCL14がどのようなメカニズムでCpG DNAを運び入れるのかは不明であった。本研究では、別のケモカインCXCL4もCXCL14より弱いながらもCpG DNAによるTLR9活性化を増強することを明らかにした。次に、CXCL14はCpG DNAと細胞表面受容体に対して異なるドメインを介して結合し、CpG DNA/CXCL14複合体はクラスリン依存性エンドサイトーシス経路によって樹状細胞内へ取り込まれることを初めて明らかとした。最後に、CXCL14の各種欠失体を用いた結合実験と分子モデリング解析によって、CXCL14のN末端側とC末端側の複数のアミノ酸が協調的に働いてCpG DNAとの結合が安定化されていることを証明した。以上の実験結果は、CpG DNA/CXCL14よるTLR9活性化の分子基盤として重要であると同時に、これが一部のCXCケモカインに保存された非古典的な機能であることを提唱する。
* 詳細は医学研トップページのTOPICS2021の中に掲載されていますので、ご覧下さい。
発表論文(鈴木輝彦 主席研究員ら)2021年4月*
KT. Suzuki, E. Katada, Y. Mizuoka, S. Takagi, Y. Kazuki, M. Oshimura, M. Shindo, and T. Hara. A novel all-in-one conditional knockout system uncovered an essential role of DDX1 in ribosomal RNA processing. Nucl. Acid Res, 49: e40, 2021.
doi:10.1093/nar/gkaa1296.
(内容紹介)調べたい遺伝子が細胞の生存に必須な場合には、Cre組換え酵素の認識配列loxPで標的遺伝子を挟み、薬剤添加によってCreを発現させて遺伝子を破壊するコンディショナルノックアウト(cKO)法が利用されている。しかし、従来法では、目的のcKO細胞が出来上がるまでにかなりの時間と労力が必要であった。そこで我々は、一度のクローニング操作で標的遺伝子をcKOすると同時に、標的遺伝子にFLAGタグを付加し、さらにその発現を緑色蛍光タンパク質EGFPで検出することができるAll-in-one cKO法を開発した。本法をマウス胚性幹細胞(ESC)に適用して、RNAヘリケースDdx1のcKO細胞を作出した。このDdx1 cKO ESCを利用してDDX1の分子機能を解析したところ、Ddx1が欠損するとリボソームRNAのプロセシングが正常に進まず、核小体ストレス経路を介してガン抑制遺伝子p53が活性化されアポトーシスが誘導されることが明らかになった。さらに、Ddx1には胚発生や悪性癌の進行と関連する上記とは別の重要な機能もあるようでる。Ddx1 cKO細胞は、それらの解明に必須なツールとなっている。All-in-one cKO法はDdx1以外の遺伝子にも適用可能であり、EGFPの発現を指標にクローニングすればヒトの培養細胞株においても63〜96%の効率でcKO細胞を作出することができる。したがって、本法は、遺伝子の分子機能解析を加速させる有用な技術になると期待される。
* 詳細は医学研トップページのTOPICS2021の中に掲載されていますので、ご覧下さい。
発表論文(北島健二 主席研究員ら)2018年9月
K. Kitajima, M. Kanokoda, M. Nakajima, and T. Hara. Domain-specific biological functions of the transcription factor Gata2 on hematopoietic differentiation of mouse embryonic stem cells. Genes Cells, 23: 753-766, 2018.
(内容紹介)我々は以前、マウス胚性幹細胞から分化誘導した造血性血管内皮細胞Hemogenic endothelial cellsに転写制御因子Gata2を過剰発現させると、赤血球と巨核球系統の血液細胞が選択的に分化誘導されることを報告した。このとき、マクロファージ系統の細胞分化はGata2によって強力に抑制された。そこで今回、Gata2とGata4の各種キメラタンパク質を作出して、血液細胞分化誘導におけるGata2の機能ドメイン同定を試みた。その結果、Gata2のN末端1-110領域が赤血球誘導に、111-200/290-393/413-480領域が巨核球の分化誘導にそれぞれ必須な役割を果たしていることが判明した。さらに、111-200領域は赤血球分化を、339-393領域はマクロファージ分化を抑制する働きをしていた。これらの実験結果は、分子内相互干渉によってGata2の機能が微調節されていることを示唆している。
発表論文(田中貴代子 主任研究員ら)2018年8月
K. Tanaka, N. Ikeda, K. Miyashita, H. Nuriya, and T. Hara. DEAD box protein DDX1 promotes colorectal tumorigenesis through transcriptional activation of the LGR5 gene. Cancer Sci., 109: 2479-2489, 2018.
(内容紹介)DEAD box型RNAヘリケースDDX1は、精巣腫瘍の発症に重要な役割を果たす。しかし、DDX1が大腸癌など他の上皮性悪性腫瘍にも関与しているかどうかは不明であった。そこで我々は、ヒト大腸癌細胞株LoVoのDDX1遺伝子をCRISPR/Cas9を用いて破壊し、そこへDDX1発現ベクターを再導入した細胞クローンを作出した。DDX1‐KO LoVo細胞の増殖率、ソフトアガーコロニー形成率、ヌードマウス皮下での腫瘍サイズは、いずれも親株より有意に低下していた。興味深いことに、DDX1‐KO細胞では、大腸癌の発症に必須な幹細胞マーカー遺伝子LGR5の発現が顕著に抑制されていた。これらの表現型は、DDX1の再導入によっていずれもレスキューされた。LGR5遺伝子の転写開始点上流ゲノムDNAを用いたレポーターアッセイとクロマチン免疫沈降によって、DDX1はLGR5遺伝子の−1837から−1662領域と相互作用することで、転写を増強させていることが示唆された。DDX1依存的なLGR5遺伝子の発現は、他のヒト大腸癌細胞株でも確認された。以上の実験結果は、DDX1はLGR5の発現亢進を介して大腸癌の発症と形質維持に寄与していることを示す。DDX1‐LGR5軸は、大腸癌の新しい創薬ターゲットになると期待される。
発表論文(宮下和也 大学院生ら)2018年1月
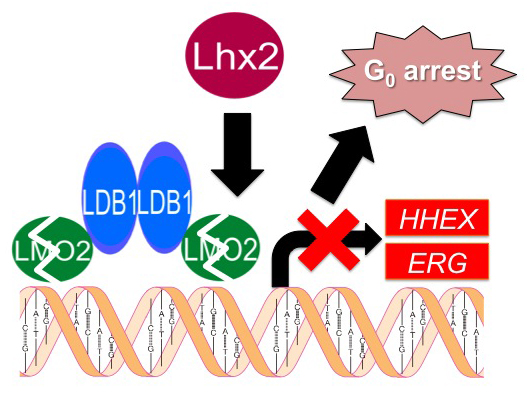
K. Miyashita, K. Kitajima, S. Goyama, T. Kitamura, and T. Hara. Overexpression of Lhx2 suppresses proliferation of human T cell acute lymphoblastic leukemia-derived cells, partly by reducing LMO2 protein levels. Biochem. Biophys. Res. Commun., 495: 2310-2316, 2018.
(内容紹介)急性Tリンパ芽球性白血病(T-ALL)は、小児において頻発する予後不良の白血病である。転写制御補助因子LMO2はT-ALL患者の約50%で過剰発現しているT-ALL発症の主要な原因遺伝子である。我々は、ES/iPS細胞から造血幹細胞を体外増幅する研究の中で、転写制御因子Lhx2がLMO2タンパク質の分解を促進することを見つけていた。そこで、Lhx2をT-ALLを含む様々なヒトがん細胞株に過剰発現してみたところ、CCRF-CEMを含む5種類のヒトT-ALL由来細胞株の増殖が顕著に阻害された。同様のことは、Bリンフォーマ細胞株や上皮性癌細胞株では観られなかった。Lhx2を過剰発現させたCCRF-CEM細胞では、LMO2タンパク質が減り、その下流遺伝子HHEX, ERGとHES1, MYCのmRNA発現レベルが顕著に低下した。この表現型は、Lmo2の同時過剰発現によって部分救済された。以上の実験結果は、Lhx2にはLMO2タンパク質の分解を促進することでT-ALL細胞の増殖を特異的に抑制する活性があることを証明する。しかし、Lhx2による増殖抑制には、C末端側LIMドメインとホメオドメインの両者が必須であった。LMO2はLIMドメインと相互作用するため、それとは別のLhx2ターゲットが存在することも示唆された。Lhx2は、T-ALL治療薬を開発するための新しい分子ツールになると期待される。
発表論文(種子島幸祐 主席研究員ら)2017年10月
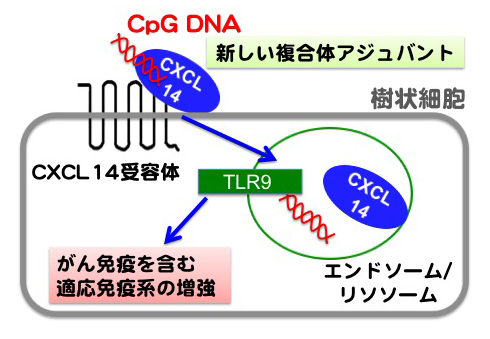
K. Tanegashima, R. Takahashi, H. Nuriya, R. Iwase, N. Naruse, K. Tsuji, A. Shigenaga, A. Otaka, and T. Hara. CXCL14 acts as a specific carrier of CpG DNA into dendritic cells and activates Toll-like receptor 9-mediated adaptive immunity. EBioMed., 24: 247-256, 2017.
(内容紹介)CXCL14はマクロファージを誘引する炎症性ケモカインの一つであるが、抗腫瘍活性をあわせ持つことが報告されている。しかし、詳細な分子メカニズムはまだ解明されていない。我々は、CXCL14がCpG DNAの細胞内取り込みを促進することで、Toll-like receptor 9(TLR9)を効率よく活性化することを発見した。CXCL14は中性条件下においてCpG DNAと高親和性で結合し(Kd= 9.8 nM)、この複合体は骨髄由来樹状細胞(BMDC)やリンパ節・脾臓内の樹状細胞に高効率で取り込まれた。BMDCでは、CXCL14とCpG DNAの共刺激によって、IL-12やIL-6といったTh1型のサイトカインが強力に誘導され、T細胞の活性化に必要なMHC class IIやCD86の発現レベルが上昇した。CXCL14欠損マウスでは、CpG DNA投与によるIL-12の産生亢進が起こらなかった。以上の実験結果は、CXCL14にはCpG DNAの細胞内運搬を助けることで適応免疫系を活性化する機能があることを示唆する。このようなケモカインは、これまでに例がない。CXCL14とCpG DNAとを組み合わせた複合体アジュバントは、腫瘍免疫を効率的に活性化できる可能性がある。
発表論文(種子島幸祐 主席研究員ら)2017年1月
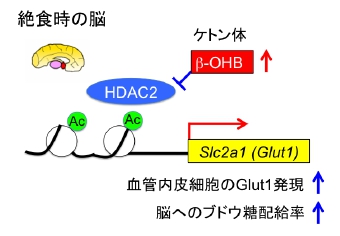
K. Tanegashima, Y. Sato-Miyata, M. Funakoshi, Y. Nishito, T. Aigaki, and T. Hara. Epigenetic regulation of the glucose transporter gene Slc2a1 by β-hydroxybutyrate underlies preferential glucose supply to the brain of fasted mice. Genes Cells, 22: 71-83, 2017.
(内容紹介)哺乳類の脳は大量のATPを必要とする臓器であり、その活動を維持するために血中ブドウ糖の3分の2を消費する。しかし、脳への優先的なブドウ糖供給の分子メカニズムはまだ完全には解明されていない。本研究ではまず、メタボローム解析によって、17時間絶食したマウスの脳ではブドウ糖レベルが安定に維持されていること、ケトン体β-hydroxybutyrate (β-OHB)の含有量が顕著に増加していることを示した。次に、脳血管内皮細胞におけるGlucose transporter 1 (Glut1) の発現レベルが有意に上昇することを発見した。β-OHBにはヒストン脱アセチル化酵素histone deacetylase (HDAC) の阻害剤として遺伝子発現を脱抑制する働きがある。そこで、マウスの脳微小血管内皮細胞をβ-OHBで処理してみたところ、Glut1をコードするSlc2a1遺伝子の発現レベルが有意に上昇した。このことと合致して、Slc2a1遺伝子の転写開始点上流2kbにあるcis-regulatory elementのヒストンH3K9のアセチル化が、β-OHB処理によって増加した。さらに、Slc2a1遺伝子の発現レベルがHDAC2遺伝子を破壊することによって亢進することを見出した。以上の結果は、絶食時の脳では、β-OHBが主にHDAC2の抑制を介してGlut1レベルに高め、ブドウ糖を脳血管へ優先的に取り込めるようにしていることを示唆する。
発表論文(鈴木輝彦 主席研究員ら)2016年6月
T. Suzuki, Y. Kazuki, M. Oshimura, and T. Hara. Highly efficient transfer of chromosomes to a broad range of target cells using Chinese hamster ovary cells expressing murine leukemia virus-derived envelope proteins. PLoS ONE, 11: e0157187, 2016.
(内容紹介)ヒト人工染色体(HAC)ベクターを標的細胞に導入する際には、従来ポリエチレングリコールを用いた微小核細胞融合法(PEG法)が用いられてきた。しかしPEG法による染色体ベクターの導入効率は1x10-5以下と非常に低く、HACを利用した研究において大きな障害となっていた。そこで本研究では、染色体ドナー細胞として汎用されているCHO細胞がマウス白血病ウイルス(MLV)非許容細胞であることに着目し、MLV由来のエンベロープタンパク質EnvをCHO細胞に強制発現させた。同種指向性または両種指向性Envを発現させたCHO細胞は、マウス由来細胞またはマウス・ヒト両種由来細胞と細胞融合を起こしたが、いずれもCHO細胞同士の融合を誘起しなかった。次にEnvを発現する染色体ドナーCHO細胞から微小核細胞を調製し、HAC導入効率をPEG法と比較してみたところ、今回開発した方法(retro-MMCT法)は、ヒト・サル・マウス・ラット・ウサギ由来の細胞株に対して、最大50倍以上の非常に高い効率を示した。retro-MMCT法は、HAC導入によるモデル動物の作製やヒトiPS細胞の遺伝子改変に役立つと期待される。
発表論文(川口真実 大学院生ら)2016年6月
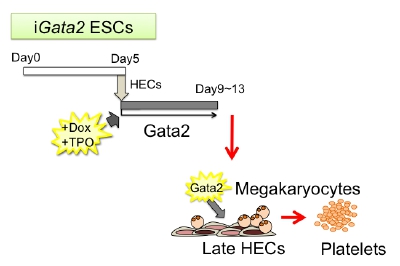
M. Kawaguchi, K. Kitajima, M. Kanokoda, H. Suzuki, K. Miyashita, M. Nakajima, H. Nuriya, K. Kasahara, and T. Hara. Efficient production of platelets from mouse embryonic stem cells by enforced expression of Gata2 in late hemogenic endothelial cells. Biochem. Biophys. Res. Commun., 474: 462-468, 2016.
(内容紹介)我々は造血幹細胞の発生に必須な転写制御因子Gata2の発現をDoxycycline (Dox)添加によって誘導できるマウス胚性幹細胞 (Embryonic stem cell: ESC)株 iGata2-ESCを樹立し、初期造血発生におけるGata2の生物活性を解析した。分化誘導5日目にHemogenic endothelial cell (HEC)を分離して、Dox存在下でOP9ストロマ細胞と共培養したところ、c-Kit陰性CD41陽性の細胞集団が選択的に分化誘導された。このc-Kit-CD41+細胞はアセチルコリンエステラーゼ陽性で巨核球コロニー形成能を有していたことから、HECから直接分化誘導される新しいタイプの巨核球と推察された。c-Kit-CD41+細胞をDoxとThrombopoietin存在下で8日間培養したところ、そこから大量の血小板が産生された。iGata2 ESC由来の血小板は微小管ネットワークで裏打ちされた円盤状の形態を持ち、α顆粒やミトコンドリアを含んでいた。また、iGata2-ESC由来の血小板は、血小板の機能に必須なCD41, CD42b, CD61を発現し、Thrombin刺激によってFibrinogenに結合して伸展した。このESC由来血小板は成獣マウスの末梢血血小板より大きく、胎生中期の血小板サイズに近かったことから、一次造血型の血小板に相当する可能性がある。本法は、iPS細胞-血小板バンク構築のための第二世代技術としてだけでなく、血小板減少症患者の発症原因究明の研究にも役立つものと期待される。
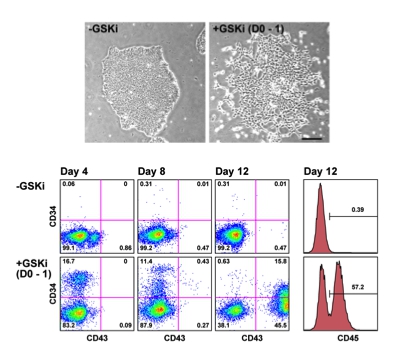
発表論文(北島健二 主席研究員ら)2016年1月
K. Kitajima, M. Nakajima, M. Kanokoda, M. Kyba, A. Dandapat, J. Tolar, M. K. Saito, M. Toyoda, A. Umezawa, and T. Hara. GSK3β inhibition activates the CDX/HOX pathway and promotes hemogenic endothelial progenitor differentiation from human pluripotent stem cells. Exp. Hematol., 44: 68-74, 2016.
(内容紹介)ヒトES/iPS細胞から造血幹細胞 (HSC) を分化誘導する技術の開発は世界中の血液学者・再生医療研究者の悲願であるが、いまだに誰も成功していない。哺乳類の胚発生において、HSCは胎生中期の決められた時期に形成されるAorta-Gonad-Mesonephros (AGM) 領域の大動脈血管内壁に存在するHemogenic endothelial cell (HEC) から出芽するようにして誕生する。AGM領域の微小環境を試験管内で模倣することが成功への王道であると考えられている。我々は今回、ヒトiPS細胞の分化誘導開始0-1日目にGSK3β阻害剤を添加することで、CD34陽性のHEC集団、そしてCD43・CD45陽性の血液細胞を効率的に分化誘導できることを見出した(図)。この分化誘導プロトコールでは、GSK3β阻害剤の一過的な処理によって、胚の後方化を促すWNT/β-CATENIN経路が活性化され、HECの発生に必須なCDX/HOX遺伝子群が転写誘導されていた。この培養系に、AGM領域の微小環境やHSCの自己複製を制御する転写因子群を組み合わせることで、ヒトiPS細胞からHSCを分化誘導できるのではないかと期待される。
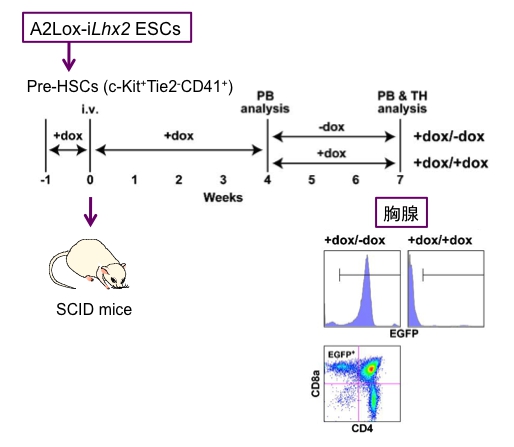
発表論文(北島健二 主席研究員ら)2015年7月
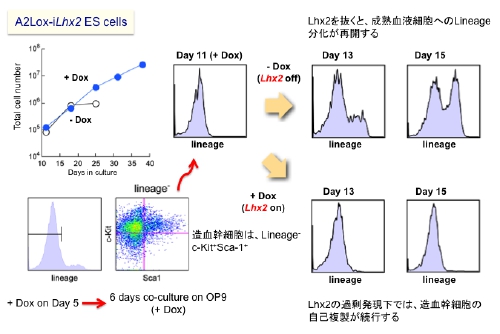
K. Kitajima, M. Kawaguchi, K. Miyashita, M. Nakajima, M. Kanokoda, and T. Hara. Efficient production of T cells from mouse pluripotent stem cells by controlled expression of Lhx2. Genes to Cells, 20: 720-738, 2015.
(内容紹介)Lhx2は、マウスES細胞から分化した造血幹細胞様の細胞集団(HSC-like cells)を体外増幅する活性を持つLIMホメオボックス型転写制御因子である。我々は以前、Lhx2をドキシサイクリン (Dox) 依存的に発現誘導できるマウスES細胞株 (A2Lox-iLhx2 ESC) を作出して、造血幹細胞の特性解析に利用してきた。A2Lox-iLhx2 ESC由来のHSC-like cellsはLhx2が過剰発現されている限り自己複製し続け、放射線照射マウスに定着した後は、赤芽球・マクロファージ・Bリンパ球などの血液細胞を作り出した。しかし、Lhx2はT細胞の最終分化を抑制するため、Lhx2を過剰発現した状態のHSC-like cellsは、放射線照射マウスに移植してもT細胞を作り出すことができない。本研究では、この技術的問題を解決した。A2Lox-iLhx2 ESC由来のHSC-like cellsを放射線照射したSCIDマウスへ移植し、Doxを含む水を与えて4週間飼育した。飲み水からDoxを除去してさらに3週間飼育したところ、末梢血と胸腺にドナー由来のCD4陽性、あるいはCD8陽性のsingle positive T細胞が大量に出現してきた(図)。Lhx2存在下では、T細胞分化はDN3ステージで停止しており、Lhx2発現をオフにすることによって、DN3からDN4への分化が急速に進んだものと推察される。またこの結果は、Lhx2を使って体外増幅したHSC-like cellsがすべての系統の血液細胞へと分化できることを証明している。HSCの自己複製と系統分化をラージスケールでコントロールできる実験系は、これが世界初である。
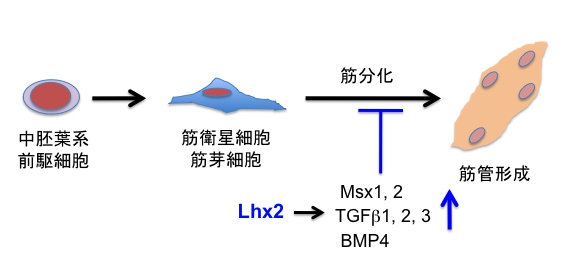
発表論文(小高悠作 大学院生ら)2015年2月
Y. Kodaka, K. Tanaka, K. Kitajima, K. Tanegashima, R. Matsuda, and T Hara. LIM homeobox transcription factor Lhx2 inhibits skeletal muscle differentiation in part via transcriptional activation of Msx1 and Msx2. Exp. Cell Res., 331:309-319, 2015.
(内容紹介)LIMホメオドメイン型転写因子Lhx2は、脳神経系の発生や毛包幹細胞の維持に必須の働きをする核内タンパク質である。Lhx2には、マウスES/iPS細胞から造血幹細胞を分化誘導し体外増幅させる活性があり、再生医療ツールとしても有望である。Lhx2は様々な種において発生中期の肢芽で強く発現しているが、骨格筋の発生分化におけるLhx2の役割は解明されていなかった。マウス筋芽細胞株C2C12や筋衛星細胞の初代培養系にLhx2を過剰発現してみたところ、分化誘導しても筋管がまったく形成されなかった。Lhx2の過剰発現細胞では、筋脱分化因子として知られているMsx1, Msx2遺伝子の発現レベルが顕著に亢進していた。詳しい分子解析の結果、両遺伝子のエンハンサー領域にはLhx2結合コンセンサス配列が2カ所ずつあり、Lhx2はそこに結合して転写活性を高めることが判明した。次に、マウス肢芽でLhx2発現をノックダウンしてみたところ、Msx1, Msx2遺伝子の発現レベルが有意に低下した。興味深いことに、Lhx2の過剰発現細胞では、筋分化抑制に作用するBMP4やTGFβファミリー遺伝子の発現レベルも高まっていた。以上の実験結果は、Lhx2は骨格筋発生の初期過程において、筋脱分化因子や中胚葉系サイトカインを発現誘導することによって筋分化を抑制し、骨格筋前駆細胞のプールを増大させる役割を果たしている可能性を示唆する(図)。事実、Lhx2/Lhx9ダブルノックアウトマウスでは、Msx1/Msx2ダブルノックアウトマウスと同様に四肢の形成が進まないことが報告されている。
発表論文(鈴木輝彦 主席研究員ら)2014年10月
T. Suzuki, Y. Kazuki, M. Oshimura, and T. Hara. A novel system for simultaneous or sequential integration of multiple gene-loading vectors into a defined site of a human artificial chromosome. PLoS ONE, 9: e110404, 2014.
(内容紹介)iPS細胞の作製やダイレクトリプログラミングによる分化転換では、複数の転写制御因子を同時に発現させる必要があるが、それぞれの発現レベルはゲノムの挿入部位に大きく依存する。また、導入れた遺伝子はゲノム中に散在するため、それらを効率的に除去することも困難である。これらの問題を解決するため、複数のベクターを同一の遺伝子受容部位へ同時に導入する新しい方法Simultaneous Integration of Multivector system (SIM system)を開発した。本法の有効性を確認するためGFP, Venus, TdTomatoの3色の蛍光タンパク質発現ユニットを3つの遺伝子導入用ベクターに組み込み、リコンビナーゼ/インテグラーゼ発現ベクターと共に遺伝子受容部位を持つヒト人工染色体(HAC)を保持するCHO細胞へ導入した。その結果、3色の蛍光を発する細胞クローンが得られ、PCR法およびFISH法によって3種類の蛍光タンパク質発現ベクターがHAC上に組換え導入されていることを確認した。さらに、改変型遺伝子導入用ベクターを利用すれば、異なるベクターを1つずつ無限に導入することも可能であることを証明した。SIM systemは、複数の遺伝子を簡便に効率良く特定の遺伝子受容部位に導入する新しい遺伝子工学技術であり、再生医療を含めて様々な分野への活用が期待される。
発表論文(北島健二 主席研究員ら)2013年12月
K. Kitajima, M. Kawaguch, M. Iacovino, M. Kyba, and T. Hara. Molecular functions of the LIM-homeobox transcription factor Lhx2 in hematopoietic progenitor cells derived from mouse embryonic stem cells. Stem Cells, 31: 2680-2689, 2013.
(内容紹介)2年前に我々は、LIMホメオボックス型転写因子Lhx2をマウスES/iPS細胞由来の中胚葉前駆細胞に過剰発現することによって、長期骨髄再建能を持つ造血幹細胞様細胞を大量に作り出せることを報告した。今回我々は、Dox誘導性Lhx2発現カセットを持つES細胞株A2Lox-iLhx2を樹立し、上記のLhx2活性の分子メカニズムを探索した。A2Lox-iLhx2を5日間分化誘導した後、Doxを添加してOP9共培養を行ったところ、c-Kit+Sca-1+Lin-(KSL)細胞(造血幹細胞を含む細胞集団)が継続的に増加した(図左)。しかし、培養系からDoxを除去すると、Lin-細胞への分化が急速に起こった(図右)。生化学的な解析を行った結果、Dox存在下では過剰量のLhx2によって分化に必要なLmo2-Ldb1複合体からLmo2タンパク質がキックアウトされ、ユビキチン-プロテアソーム系によって急速に分解されることが判明した。Lhx2とLmo2を同時に過剰発現すると、KSL細胞の含有率が低下したことから、Lhx2による造血幹細胞様細胞の体外増幅にはLmo2タンパク質の安定性が寄与している。次に我々は、Lhx2の過剰発現によってGata3遺伝子の発現レベルが高まることを発見した。A2Lox-iGata3細胞を樹立して中胚葉前駆細胞にGata3を過剰発現させてみたところ、分化の抑制(Lin-細胞の増加)が観察された。A2Lox-iLhx2細胞におけるGata3のノックダウンはKSL細胞の増殖に抑制的であったが、Gata3の過剰発現だけではKSL細胞の体外増幅には至らなかった。以上の結果から、Lhx2は血液細胞の分化スイッチを構成する複数の転写制御因子の相互作用と発現バランスを変えることによって、造血幹細胞様細胞を大量に作り出す効果を発揮しているものと推察される。
発表論文(種子島幸祐 主任研究員ら)2013年11月
*K. Tanegashima, *K. Tsuji, K. Suzuki, A. Shigenaga, A. Otaka, and T. Hara. Dimeric peptides of the C-terminal region of CXCL14 function as CXCL12 inhibitors. FEBS Letters, 587: 3770-3775, 2013. *Equally contributed.
(内容紹介)アミノ酸配列に基づく構造比較から、CXCL14のC末端領域はα-helix構造をとって二量体化していると予測した。そこで、CXCL14-C領域を化学的に連結して二量体にした人工ペプチド(ssdmCXCL14-C, oxdmCXCL14-Cc/g)を合成した。125Iで標識したCXCL14を用いたTHP-1細胞のバイディングアッセイにかけてみたところ、これらのペプチドは125I-CXCL14の高親和性受容体結合を阻害した。全長CXCL14, ssdmCXCL14-C, oxdmCXCL14-Cc/gのIC50は、それぞれ55 nM, 52 nM, 31 nMであった。CXCL14-C領域の単量体ペプチドは125I-CXCL14の受容体結合を抑える活性が弱かった(IC50 = 246 nM)ことから、CXCL14は二量体化してCXCR4と相互作用している可能性が示唆された。この結果と合致して、ssdmCXCL14-CとoxdmCXCL14-Cc/gは、THP-1細胞やBaF/3細胞のCXCL12走化性移動を特異的にブロックした。上記の合成CXCL14-C二量体ペプチドにはケモカイン活性がないため、全長CXCL14より有望なCXCL12 antagonistである。CXCL12-CXCR4軸に依存して増殖転移する多くの悪性腫瘍に対する新しい治療薬の開発原理として、本発見の活用が期待される。
発表論文(田中貴代子 主任研究員ら)2013年8月
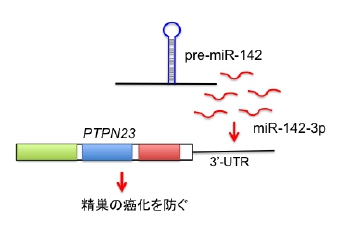
K. Tanaka, K. Kondo, K. Kitajima, M. Muraoka, A. Nozawa, and T. Hara. Tumor-suppressive function of protein-tyrosine phosphatase non-receptor type 23 in testicular germ cell tumors is lost upon overexpression of miR142-3p microRNA. J. Biol. Chem., 288: 23990-23999, 2013.
(内容紹介)PTPN23は、癌抑制活性を有するタンパク質チロシンホスファターゼの一種である。我々は、精巣腫瘍におけるPTPN23の機能と発現制御機構について解析した。まず、ヒト精巣腫瘍由来細胞株におけるPTPN23 mRNAの発現レベルは、正常な生殖系幹細胞(精原細胞)と比べて著しく低かった。ヒト精巣腫瘍細胞株NEC8にPTPN23 cDNAを過剰発現させてみたところ、軟寒天培地中でのコロニー形成能、およびヌードマウス皮下で腫瘍形成能が消失した。これらのデータは、PTPN23が精巣腫瘍抑制因子として機能することを示す。ヒトPTPN23遺伝子の3'非翻訳領域には、マイクロRNAの一種であるmiR-142-3pの標的配列が存在していた(図)。miR-142-3pが確かにその領域に結合することを、リポーターアッセイによって確認した。次に、PTPN23を過剰発現するNEC8トランスフェクタントへmiR-142前駆体を遺伝子導入してみたところ、PTPN23タンパク質の発現レベルが低下し、軟寒天培地でのコロニー形成能が逆に上昇した。最後に、精巣腫瘍患者検体を用いてPTPN23とmiR-142-3pの発現レベルをqRT-PCRによって比較解析してみたところ、PTPN23の発現量はmiR-142-3pのそれと逆相関していた。以上の結果は、miR-142-3pを介したPTPN23の発現抑制が、ヒト精巣腫瘍の発症に重要な役割を果たしていることを示唆する。
発表論文(種子島幸祐 主任研究員ら)2013年7月
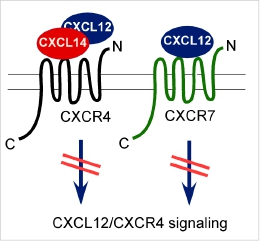
*K. Tanegashima, *K. Suzuki, Y. Nakayama, K. Tsuji, A. Shigenaga, A. Otaka, and T. Hara. CXCL14 is a natural inhibitor of the CXCL12-CXCR4 signaling axis. FEBS Letters, 587: 1731-1735, 2013. *Equally contributed.
(内容紹介)CXCL12-CXCR4シグナル経路の活性化は始原生殖細胞、神経前駆細胞、造血幹細胞等の組織幹細胞、および様々な癌細胞の遊走に関与していることが知られている。これまで、CXCL12はCXCR4の唯一のケモカインリガンドと考えられてきた。今回我々は、CXC タイプのケモカインCXCL14が、CXCR4に高親和性で結合し、CXCL12によるケモタキシス活性を阻害することを見出した。ヒト単球性白血病細胞株THP-1にCXCR4を過剰発現させたところ、125I-CXCL14CXCL14の高親和性結合部位が増加し、逆にsiRNAを用いてCXCR4をノックダウンさせると、その数が減少した。また、ヒトCD34+造血前駆細胞、THP-1、ヒトT細胞性白血病細胞株Jurkatにおいて、CXCL14はCXCL12のケモタキシス活性をほぼ完全に阻害した。以上の結果は、CXCL14はCXCR4への高親和性結合を介してCXCR4-CXCL12シグナル経路を阻害することを示唆する(図)。CXCL14はCXCL12と並んで、魚からヒトまでアミノ酸配列が高度に保存されているケモカインである。CXCL14は、発生再生に重要な役割を果たすCXCR4-CXCL12シグナル経路の強さを微調整する分子として、non-signaling受容体CXCR7と共にゲノム内に保存されてきたものと推察される。
発表論文(北島健二 主席研究員ら)2011年12月
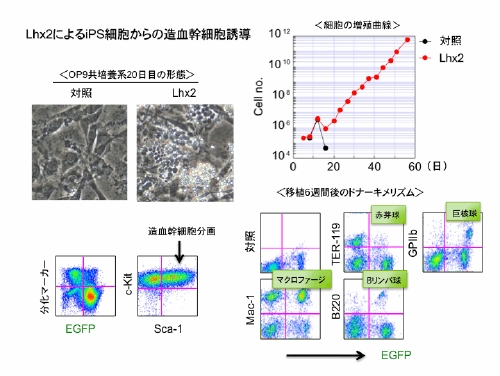
K. Kitajima, K. Minehata, K. Sakimura, T. Nakano, and T. Hara. In vitro generation of HSC-like cells from murine ESCs/iPSCs by enforced expression of LIM-homeobox transcription factor Lhx2. Blood, 117: 3748-3758, 2011.
(内容紹介)ES・iPS細胞からの造血幹細胞をin vitro誘導する方法の開発 Lhx2 は毛根幹細胞の自己複製に関与するLIMホメオボックス型転写制御因子である。マウスES細胞由来の中胚葉細胞にLhx2を遺伝子導入し、OP9細胞との共培養により造血系へ分化誘導したところ、コントロール培養系と比べてはるかに多くの造血前駆細胞が増殖し、造血幹細胞の表現型であるc-Kit+Sca-1Lin- 細胞の絶対数が顕著に増加した(図)。この効果は、同様の活性が報告されているHoxB4を遺伝子導入した場合より、約7倍高かった。Lhx2導入によって誘導した造血前駆細胞を放射線照射した同系マウスに移植したところ、T細胞を除くすべての系統の成熟血液細胞がドナーからin vivo分化し(図)、長期に維持された。骨髄再建細胞の二次移植も成立し、これらの骨髄キメラマウスは今のところ白血病を発症していない。同様の結果は、我々が樹立したC57BL/6マウス由来の複数のiPS細胞株でも再現した。以上の結果から、Lhx2はマウスES・iPS細胞から長期骨髄再建性の造血幹細胞を効率的に分化誘導するパワフルな分子ツールであることが証明された。iPS細胞からの造血幹細胞誘導法の開発は、基礎と応用の両面から生物医学研究に貢献する。このシステムを使えば、造血幹細胞の発生や自己複製の機序に迫れるであろうし、再生医療と直結する他の組織幹細胞をiPS細胞から分化誘導するのにも役立つ可能性がある。
発表論文(戸倉由香 大学院生、中山由紀 研究員ら)2010年9月
Y. Tokura, Y. Nakayama, S. Fukada, N. Nara, H. Yamamoto, R. Matsuda, and T. Hara. Muscle injury-induced thymosin beta4 acts as a chemoattractant for myoblasts. J. Biochem., 149: 43-48, 2011.
(内容紹介)サイモシンbeta4は、細胞質でGアクチンに結合する主要なペプチドである。近年の研究により、細胞外に分泌されたサイモシンbeta4は、血管新生・損傷治癒・心筋再生に重要な役割を果たすことが明らかになった。我々は、骨格筋再生過程におけるサイモシンbeta4と近縁のサイモシンbeta10遺伝子の発現、およびそれらに対する筋芽細胞の走化性について検討した。筋損傷マウスにおいて両者のmRNAは、再生筋と炎症性血液細胞とで発現高進していた。サイモシンbeta4とその硫酸化体は、C2C12筋芽細胞の細胞剥離修復と走化性移動を促進した。さらに、成獣マウス骨格筋衛星細胞由来の筋芽細胞と筋細胞は、硫酸化サイモシンbeta4に対する走化性を示した。これらのデータは、筋損傷がサイモシンbeta4の発現を局所的に増加させ、筋芽細胞を呼び寄せることによって筋再生を促進する、という仕組みを示唆する。
発表論文(大林謙一郎 大学院生、田中貴代子 主任研究員ら)2010年7月
K. Ohbayashi, K. Tanaka, K. Kitajima, K. Tamura, and T. Hara. Novel role for the intraflagellar transport protein CMG-1 in regulating the transcription of cyclin-D2, E-cadherin, and integrin-a family genes in mouse spermatocyte-derived cells. Genes to Cells., 15: 699-710, 2010.
(内容紹介)我々は、精原細胞に発現しES細胞に発現していないマウス遺伝子群の中からCMG-1遺伝子を同定した(藤野ら、2006年)。CMG-1はクラミドモナスの繊毛タンパク質IFT-71のマウスオルソログである。マウス精母細胞由来GC-2細胞株のCMG-1 mRNA発現をsiRNAによってノックダウンしてみたところ、cyclin-D2, E-cadherin遺伝子の発現が消失し、さらに integrin-a1, integrin-a2, integrin-a10, integrin-a11遺伝子の発現レベルがそれぞれ低下した。これらの遺伝子発現抑制は、siRNA抵抗性CMG-1 cDNAの誘導的発現によっていずれもレスキューされたことから、オフターゲット効果によるものではない。上記の4つのintegrin-aサブユニットは、integrin-b1とヘテロダイマーを形成し、1型コラーゲン受容体として働くことが知られている。このことと合致して、CMG-1をノックダウンしたGC-2細胞は、1型コラーゲンをコートした培養皿ではほとんど増殖できなかった。また細胞形態も敷石形から紡錘形へと変化した。
レポーターアッセイ、ゲルシフトアッセイ、クロマチン免疫沈降実験を行った結果、CMG-1タンパク質はcyclin-D2遺伝子プロモーター領域の-250 ~ -216領域に結合し、転写を正に制御することが判明した。-250 ~ -216領域と相同性を有する配列は、E-cadherin, integrin-a1, integrin-a2, integrin-a10, integrin-a11遺伝子の転写開始点上流域(-200 ~-900塩基対)にも存在していた。以上の実験結果は、CMG-1タンパク質が細胞の増殖と接着性を制御する新しいタイプの転写活性化因子として働くことを証明する。CMG-1は、骨髄にも発現していることから、精巣だけでなく造血幹細胞の自己複製とニッチ定着にも関与する重要な分子である可能性がある。
発表論文(種子島幸祐 主任研究員ら)2010年4月
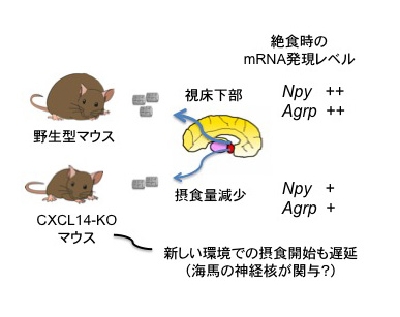
K. Tanegashima, S. Okamoto, Y. Nakayama, C. Taya, H. Shitara, R. Ishii, H. Yonekawa, Y. Minokoshi, and T. Hara. CXCL14 deficiency in mice attenuates obesity and inhibits feeding behavior in a novel environment. PLoS ONE, 5: e10321, 2010
(内容紹介)C57BL/6バックグラウンドのCXCL14-KOマウスは、対照野生型マウスと比べて7~11%体重が軽く、この表現型は雌マウスの方が顕著であった。CXCL14-KOマウスの示す低体重の主な原因は摂食量の減少にあったが、CXCL14が中枢における摂食調節機能とどう関わっているのかはまだ解っていない。本研究では、この謎に迫った。一般に、マウスを絶食させると、視床下部におけるNpyとAgrpのmRNA発現量が上昇し、Pomc, Socs3, CartのmRNAレベルが低下する。CXCL14-KOマウスの視床下部では、絶食によるNpyとAgrpの発現誘導が野生型マウスと比べて有意に減弱していた。しかし、組換え体CXCL14をCXCL14-KOマウスの脳室内、あるいは腹腔内に投与してみたところ、有意な摂食促進効果は観察されなかった。したがって、CXCL14は摂食関連神経ネットワーク、特にNpy/Agrpニューロンの成立過程に何らかの役割を担っている可能性が示唆される。興味深いことに、CXCL14-KOマウスを新しい型の飼育ケージに移動させると、その夜の摂食量が著しく減少し、3日目にやっと元のレベルまで回復した。この間、CXCL14-KOマウスの昼夜の総行動量は野生型マウスと変わらなかった。この行動特性は、CXCL14-KOマウスの低体重を直接説明するものではないが、CXCL14欠損により新しい環境への適応が遅れること、そして特に摂食行動に影響が出ることを示した初めての実験的証拠である。現時点での我々の作業仮説を模式図にまとめた。今後は、摂食関連脳領域におけるCXCL14応答性神経核の同定に挑んでいく。なお、本論文では、C57BL/6バックグラウンドのCXCL14-KOマウスの生誕率が、雌雄ともにメンデルの法則の期待値の半分以下となることも示している。
発表論文(種子島幸祐 主任研究員ら)2010年1月
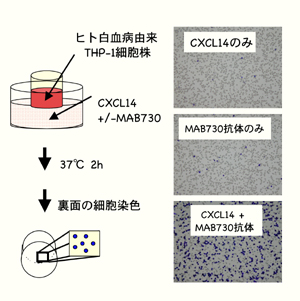
K. Tanegashima, K. Suzuki, Y. Nakayama, and T. Hara. Antibody-assisted enhancement of biological activities of CXCL14 in human monocytic leukemia-derived THP-1 cells and high fat diet-induced obese mice Exp. Cell Res., 316: 1263-1270, 2010.
(内容紹介)CXCL14は樹状細胞前駆細胞やNK細胞を誘引するケモカインである。以前我々は、KOマウスを用いた解析により、CXCL14が肥満性糖尿病の悪化因子であることを証明し報告した。しかし、CXCL14の細胞誘引活性は他のケモカインと比べて弱いため、受容体の探索や阻害剤のスクリーニングを行うことが困難であった。今回我々は、CXCL14のケモタクシス活性を顕著に増大させるモノクローナル抗体MAB730を同定するのに成功した。ヒト単球系白血病由来の細胞株THP-1は、CXCL14に対して微弱な走化性しか示さないが、この抗CXCL14抗体を添加すると、100倍以上のTHP-1細胞がチャンバーの裏側に向かって移動するようになる(模式図参照)。125I標識したCXCL14を用いて、THP-1細胞のバイディングアッセイを行った結果、MAB730抗体はCXCL14の低親和性受容体への結合を特異的にブロックした。また、抗体のF(abユ)2断片には活性が残るが、Fab断片にすると活性が消失した。したがって、MAB730を介したCXCL14の活性増大には、グルコーサミノグリカンを介した低親和性結合部位へのトラップ解除とリガンドの二量体化とが関与しているものと推察される。次に、この活性増進型抗CXCL14モノクローナル抗体を、高脂肪食飼育した野生型雌マウスに投与してみたところ、個体レベルでのインスリン抵抗性が増加し、耐糖能が悪化した。この実験結果は、CXCL14がインスリン感受性を低下させる重要な代謝制御因子であること示す第二の証拠である。MAB730抗体を添加したCXCL14ケモタクシスアッセイは、今後の受容体・阻害剤の探索研究に役立つものと期待される。
発表論文(田中貴代子 主任研究員ら)2009年5月
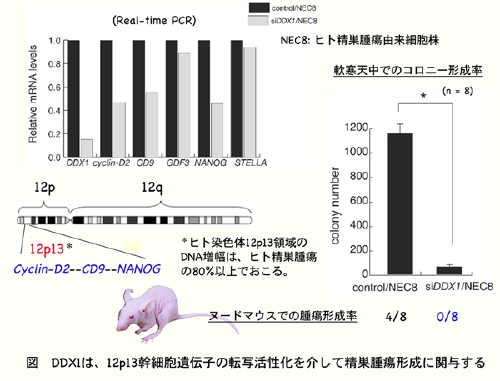
K. Tanaka*, S. Okamoto, Y. Ishikawa, H. Tamura, and T. Hara*. DDX1 is required for testicular tumorigenesis, partially through the transcriptional activation of 12p stem cell genes. Oncogene, 28: 2142-2151, 2009. *Corresponding author.
(内容紹介)我々はマウス胎仔の始原生殖細胞に発現する遺伝子のひとつとして、DEAD box protein familyに属するRNAヘリケースDDX1を同定した。DDX1タンパク質は成獣マウス精巣の精原細胞に強く発現していた。マウス精原細胞由来GC1細胞株におけるDDX1 mRNAの発現をsiRNA導入によりノックダウンすると、cyclin-D2, CD9, GDF3などのmRNA発現が顕著に低下した。マウスcyclin-D2遺伝子の転写開始点上流ゲノムDNAを用いたレポーターアッセイ、およびゲルシフトアッセイの結果から、DDX1はcyclin-D2遺伝子の-369 ~ -351領域に直接結合し、転写活性を高める働きをしていた。DDX1により発現制御を受けるcyclin-D2, CD9, GDF3遺伝子はいずれもヒト精巣腫瘍の70%でゲノムDNA増幅がおこる染色体12p13.3領域に局在している。そこで、ヒト精巣腫瘍由来細胞株NEC8のDDX1発現をsiRNA導入によりノックダウンしてみたところ、マウスGC1細胞株のケースと同様にcyclin-D2, CD9, GDF3遺伝子のmRNA発現が低下した。さらに、やはり12p13.3領域に局在するNANOG遺伝子の発現レベルもDDX1ノックダウンによって低下した。DDX1を発現抑制したNEC8細胞株では、空ベクターを導入したコントロール細胞と比べて、軟寒天培地でのコロニー形成能が顕著に低下し、ヌードマウス皮下での造腫瘍活性が消失した。これらの実験結果は、DDX1が12p13.3領域に局在する幹細胞遺伝子群の転写活性化因子として、精巣腫瘍の誘導に必須な役割を果たしていることを強く示唆する。
発表論文(原 孝彦、風間律子 大学院生ら)2008年1月
T. Hara*, M. Schwieger, R. Kazama, S. Okamoto, K. Minehata, M. Ziegler, J. Lohler, and C. Stocking. Acceleration of chronic myeloproliferation by enforced expression of Meis1 or Meis3 in Icsbp-deficient bone marrow cells. Oncogene, 27: 3865-3869, 2008. *Corresponding author.
(内容紹介)TALEファミリーに属するホメオプロテインMeis1は、造血幹細胞の胎仔肝臓での増幅に重要な役割を果たす。また、Mesi1はHoxA9遺伝子やNUP98-Hox転座遺伝子の高発現を介した急性骨髄性白血病(Acute myeloid leukemia, AML)の発症にも必須であることが最近証明された。我々は、Meis1およびMeis3が幹細胞の自己複製や白血病化にどのように関わっているのかに興味を持ち、数年をかけて研究してきた。その成果として、昨年Meis1/Mesi3がHoxとは別の遺伝子発現変異と相互作用して白血病を引き起こすことを突き止めた (Oncogene, in press)。Interferon consensus sequence binding protein (ICSBP, 別名IRF-8)ノックアウトマウス[ICSBP(-/-)マウス]は、骨髄球系前駆細胞が増加する慢性骨髄性白血病 (Chronic myeloid leukemia, CML)のモデル実験動物であり、AML発症の分子機構を研究するツールとして有用な系統である。AML患者においても66%の割合でICSBP遺伝子の発現低下が報告されていることから、ICSBP欠損はAML発症の主要な一次変異と考えられる。そこで我々は、Meis1あるいはMeis3 cDNAをICSBP(-/-)マウスの骨髄造血幹細胞に遺伝子導入した後、放射線照射した正常C57BL/6マウスに移植した。これらのマウスは移植後70日くらいから骨髄球増加症(Myeloproliferative disease, MPD)を発症し、さらに主要臓器への顆粒球浸潤とAML転化を経て、ほぼすべての個体が200日までに致死となった。この現象はICSBP(+/+)コントロールマウスの造血幹細胞にMeis1/Meis3 cDNAを導入したときにはおこらなかった。発症マウスの脾臓と肝臓におけるレトロウイルスのゲノム挿入部位をサザンブロッティングによって解析してみたところ、MPDマウスはオリゴクローナル、AMLマウスはクローナルであることがわかった(図1a)。すなわち、ICSBP欠損とMeis1高発現は直接にMPDを引き起こすが、AML発症にはさらに二次的な遺伝子変異が必要である。このAML転化の原因となった第3の遺伝子をinverse PCR法によりクローニングしたところ(Stocking博士 との共同研究)、それはHox遺伝子ではなくMn1遺伝子であった。Mn1はNUP98-HoxD13転座遺伝子産物と共同して働きAML発症を促進させる遺伝子のひとつである。この実験結果は、ICSBP欠損-Meis1高発現-Mn1高発現の組み合わせがAML発症の原因となることを証明する。Hox遺伝子群の間接的な関与を排除することはできないが、Hox以外の複数のリスク遺伝子の変異の積み重ねによってもAML発症がおこることを明確に示す結果である。
発表論文(奈良典子、中山由紀 研究員ら)2007年8月
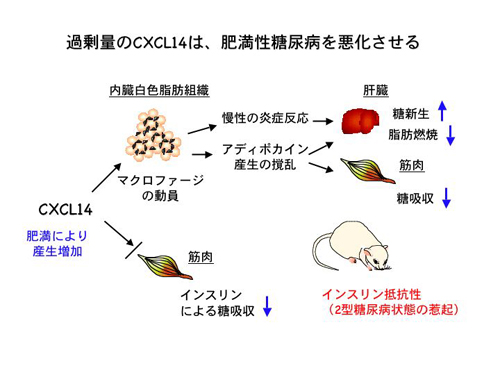
N. Nara*, Y. Nakayama*, S. Okamoto, H. Tamura, M. Kiyono, M. Muraoka, K. Tanaka, C. Taya, H. Shitara, R. Ishii, H. Yonekawa, Y. Minokoshi, and T. Hara. Disruption of CXC motif chemokine ligand-14 in mice ameliorates obesity-induced insulin resistance. J. Biol. Chem., 282: 30794-30803, 2007. *First two authors were equally contributed.
(内容紹介)組織に内在するマクロファージは、炎症反応の促進や異物の貪食をするだけでなく、損傷臓器の修復や脂質代謝にも重要な機能を果たすことが近年明らかにされている。我々は、筋萎縮症マウスの骨格筋で発現高進している遺伝子産物のひとつとして、組織マクロファージに作用するケモカインCXCL14(別名BRAK)を同定した。CXCL14は癌組織で発現消失するCXCタイプのケモカインとして、1999年に米国のグループによって遺伝子クローニングされた。その後の研究により、活性化された組織マクロファージだけでなく、樹状細胞前駆細胞や乳癌上皮細胞株もCXCL14に誘引されて組織内へと浸潤することが示された。しかし、CXCL14の個体における生理的機能はまだ明らかにされていなかった。CXCL14 mRNAは、脳・肺・筋肉・脂肪組織に加えて、子宮と卵巣でも強く発現していたが、精巣では発現していなかった。そこで、我々はこの遺伝子を相同組換えにより破壊したマウス(以下、CXCL14-KOマウスと呼ぶ)を作出した。CXCL14-KOマウスでは、平均体重が同腹コントロールマウスと比べ約16%軽く、さらに内蔵白色脂肪の蓄積量がコントロールマウスの約38%に減少していた。しかし、白色脂肪組織に含まれるマクロファージ数は、CXCL14-KOマウスとコントロールマウスとで変化がなかった。マウスに高脂肪食を与えて12週間以上飼育すると、過食の分だけ内蔵白色脂肪量が蓄積し、そこに浸潤するマクロファージ数も増加することが知られている。マクロファージが惹起する慢性の炎症反応が一因となって、肥満マウスはインスリン抵抗性の2型糖尿病となる。我々の実験結果によれば、高脂肪食飼育により肥満となったマウスの内蔵白色脂肪ではCXCL14のmRNA発現とマクロファージ数が増加していた。しかし、CXCL14-KOマウスでは高脂肪食飼育に伴う白色脂肪内のマクロファージ数の増加がおこらず、肥満で誘導されるインスリン抵抗性の発症も改善されていた。また、高脂肪食飼育したCXCL14-KOマウスでは、血糖値を調節するインスリンや各種アディポカイン(アディポネクチンやRBP4など)の肥満に伴う血中レベル変動が緩和され、脂肪肝も改善されていた。次に、CXCL14を骨格筋でのみ発現させたトランスジェニックマウスを作出し、CXCL14-KOマウスと交配させたところ、肥満によるインスリン抵抗性誘導がレスキューされた。さらに我々はCXCL14が骨格筋細胞のインスリン応答を直接阻害する活性を持つことを見出した。これらの実験結果は、CXCL14はマクロファージの浸潤を介して脂肪組織での慢性炎症反応を誘導するだけでなく、糖吸収の主要組織である骨格筋の機能を直接阻害している可能性を示唆する。CXCL14は単なる炎症性ケモカインではなく、個体のエネルギー代謝を制御する重要なサイトカインであると推察される。
発表論文(藤野隆介 大学院生ら)2006年8月
Fujino, R.S., Ishikawa, Y., Tanaka, K., Kanatsu-Shinohara, M., Tamura, K., Kogo, H., Shinohara, T., and Hara, T. Capillary morphogenesis gene (CMG)-1 is among the genes differentially expressed in mouse male germ line stem cells and embryonic stem cells. Mol. Reprod. Dev., 73: 955-966, 2006.
(内容紹介)我々は石川雄一郎博士(臨床研・マイクロアレイ室)、篠原隆司博士(京大医学部)らとの共同研究として、精原細胞に発現しES細胞に発現していないマウス遺伝子群をマイクアレイ解析により同定した。その中から当初機能未知であったcapillary morphogenesis gene (CMG)-1遺伝子を選び、その発現と機能を解析した。CMG-1遺伝子は、データベース上でcoiledミcoil domain containing 2 (ccdc2)として登録されており、血管内皮細胞HUVECがin vitroで毛管形成するときに発現低下する遺伝子の1つとして、2001年に報告・命名された。この時点ではCMG-1タンパク質の機能は何も解っていなかった。我々はまずin situ hybridizationと精巣の細胞分画のRT-PCR解析によって、CMG-1 mRNAが成獣マウス精巣の精原細胞と精母細胞とに発現していることを確認した。CMG-1のmRNA発現量は、精巣以外では、肺、脾臓、子宮で高かった。次に、マウス精母細胞株GC-2spd(ts)を用いてCMG-1 mRNA発現をsiRNAによってノックダウンしてみたところ、細胞増殖速度に変化は観られなかったが、コンフルエント状態での細胞形態が紡錘形に変化し、さらにcyclin D2の発現がmRNA・タンパク質ともに消失した。このとき、cyclin D1, cyclin D3など他の細胞増殖関連遺伝子のmRNA発現レベルには影響が出なかったことから、CMG-1ノックダウンによるcyclin D2の発現消失は非特異的な転写抑制ではない。次にGC-2spd(ts)株を用いてマウスcyclin D2遺伝子プロモーター領域のレポーターアッセイをおこない、このCMG-1ノックダウンによるcyclin D2の発現消失が転写レベルでおこっていることを証明した。Flagタグを付けたCMG-1 cDNAのトランスフェクション実験によりCMG-1タンパク質が核に局在していたことから、CMG-1は cyclin D2の転写を制御する核内タンパク質であると我々は結論した(図)。ただし、CMG-1によるcyclin D2遺伝子の転写活性化が、プロモーター領域DNAへ直接結合することによるのか、それとも他の転写調節タンパク質への結合を介するものなのかについてはまだ不明であり、現在解析を進めている。この研究を進めていた2004年、CMG-1がクラミドモナスの繊毛タンパク質IFT-71のマウスオルソログであることが米国のグループにより発表された。この論文ではCMG-1タンパク質は血管内皮細胞の繊毛内に局在し、血管内の物質フローの調節に関与していると記載されている。また、CMG-1を最初に同定した論文では、CMG-1タンパク質はゴルジ体周囲の膜小胞に局在すると報告している。しかし、我々の解析ではCMG-1遺伝子産物は核に局在しており、上述のようにそれをノックダウンすると少なくともcyclin D2遺伝子の転写が抑制された。したがって、CMG-1タンパク質は、血管内皮細胞では繊毛タンパク質として働くが、精母細胞ではまったく異なる役割を果たしている可能性がある。べん毛や繊毛は細胞の遊走や周囲物質の流れをおこす働きを持つ。哺乳類の細胞にも無数の繊毛があることが知られているが、べん毛・繊毛内部の物質輸送がどのように制御されているかについては、これまで緑藻類クラミドモナスを用いて詳細な研究がなされてきた。最近、クラミドモナスのキネシン温度感受性変異体を用いて、べん毛内輸送系が機械的な運動だけでなく、接合成立のための細胞内シグナル伝達にも必須の役割を果たすことが報告された。また、マウスの繊毛内輸送系がHedgehogによる転写因子Gliの活性化に関与しているというレポートもある。まだこれは机の上での推測だが、CMG-1タンパク質はべん毛・繊毛という細胞の末端部と核との間における転写因子(あるいはそれを修飾する酵素)の移動を制御するシャトルとして働いている可能性がある。我々の精母細胞株を使った今回の実験結果は、細胞種に依存したCMG-1タンパク質の異なる機能を観ているのではなく、細胞内輸送系による新たな転写調節のしくみを写し出しているのかもしれない。
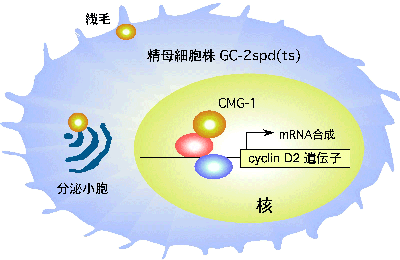
発表論文(藤野隆介 大学院生ら)2006年4月
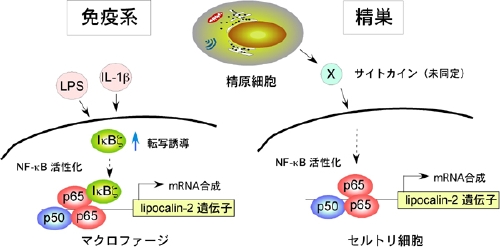
R. Fujino, K. Tanaka, M. Morimatsu, K. Tamura, H. Kogo, and T. Hara. Spermatogonial cell-mediated activation of an IkBz-independent NF-kB pathway in Sertoli cells induces transcription of the lipocalin-2 gene. Mol. Endocrinol, 20: 904-915, 2006.
(内容紹介)精巣の分化と機能成熟は、幹細胞である精原細胞とそれをとりまくセルトリ細胞との相互作用により制御されている。精原細胞の増殖と分化が、セルトリ細胞から産生されるGDNFとSCFによってそれぞれ制御されているのが代表例である。我々は、W/Wv変異マウスの精巣では精原細胞のみが欠失しているにもかかわらず、複数のセルトリ細胞遺伝子の発現がシャットダウンされていること、そしてそれらのセルトリ細胞遺伝子の発現は精原細胞の蓄積しているjsd/jsd変異マウスの精巣では高進していることを見出していた。これらの事実は、一群のセルトリ細胞遺伝子は精原細胞依存的に発現制御されている可能性、すなわち精原細胞からセルトリ細胞への情報伝達が起っていることを示唆する。今回、我々はリポカリン2(別名24p3、NGAL)遺伝子のmRNA発現を指標にして、上記の現象を新生マウス精巣由来の初代セルトリ細胞と精原細胞との共培養によって再現した。リポカリン2タンパク質は、細菌の増殖に必須な鉄を運ぶタンパク質と高い親和性で結合するため、哺乳類を細菌感染から防御する役割を担っている。炎症反応時に出されるリポポリサッカライド(LPS)やインターロイキン1(IL-1)の刺激によって、マクロファージはリポカリン2を大量に産出することが知られている。一方、リポカリン2は精子の運動性を高めるとの報告もある。精原細胞によるセルトリ細胞遺伝子の発現誘導機構を明らかにする目的で、新生マウス由来セルトリ細胞株 (Sertoli B) を新たに樹立し、リポカリン2遺伝子のプロモーター領域解析を行った。Sertoli B細胞株に、リポカリン2遺伝子転写開始点上流3 kbのゲノムDNAを挿入したレポータープラスミドを導入し、精原細胞と接触培養したところ、リポカリン2遺伝子の転写活性が高進した。さらにこのアッセイを用いて転写活性化領域を徐々に短縮していき、精原細胞によるリポカリン2遺伝子の転写活性化に必要な責任領域を同定した。ここには転写因子NF-kBのコンセンサス配列が存在していた。そこで、クロマチン免疫沈降実験を行ったところ、NF-kBのp65がリポカリン2遺伝子プロモーター領域に特異的に結合し、精原細胞刺激依存的に核に移行することが判明した。さらにドミナントネガティブIkBaの強制発現や、siRNAを用いたNF-kBp65およびp50のノックダウンにより、精原細胞によるリポカリン2遺伝子の転写誘導は抑制された。リポカリン2遺伝子の転写誘導活性は精原細胞の培養上清に存在し、この活性物質は熱処理により失活した。精原細胞の培養上清でSertoli B細胞株を刺激した時のリポカリン2遺伝子レポーター活性は、LPSやIL-1bで刺激した時の値よりも高かった。マクロファージをリLPSやIL-1刺激した時には、NF-kBの別のコンポーネントであるIkBzが転写誘導され、これがリポカリン2遺伝子の転写誘導を引き起こすことが2004年に報告された。そこでセルトリ細胞におけるリポカリン2遺伝子の転写誘導も同様の仕組みでおこっているかどうかを決める目的で、IkBzノックアウトマウス(北大・森松正美博士より供与)を解析したところ、精巣におけるリポカリン2遺伝子の発現レベルはIkBzの有る無しに依存していなかった。以上の一連の実験結果は、セルトリ細胞では精原細胞から分泌されるサイトカインによりNF-kB経路が活性化されてリポカリン2遺伝子の転写活性化が引き起こされていること、しかしそのシグナル伝達様式は細菌感染時の免疫系細胞のそれとは異なっていること、を証明する(図)。精原細胞から分泌されるリポカリン2誘導性のサイトカインは、精巣の抗菌性を維持する上で重要な働きをしているものと推察され、現在その分子としての実体解明に取り組んでいる。
発表論文(岩槻健 研究員ら)2005年2月
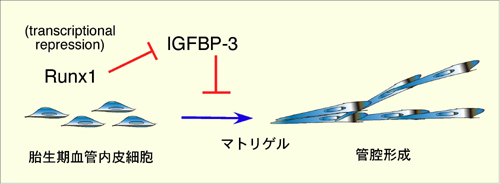
K. Iwatsuki, K. Tanaka, T. Kaneko, R. Kazama, S. Okamoto, Y. Nakayama, Y. Ito, M. Satake, S. Takahashi, A. Miyajima, T. Watanabe, and T. Hara. Runx1 promotes angiogenesis by downregulation of insulin-like growth factor binding protein-3. Oncogene, 24: 1129-1137, 2005.
(内容紹介)Runx1は造血発生に必須であると同時に、造血幹細胞によるAngiopoietin-1の供給を介して胎仔器官の血管網の発達にも寄与する。近年、Runx2や共通の結合パートナーであるCBFbのドミナントネガティブ体の強制発現実験により、Runx1, 2が血管内皮細胞の移動や管腔形成に直接関与する可能性が報告された。我々は、Runx1ノックアウトマウス胎仔AGM領域に由来する血管内皮前駆細胞株AEL-DR1を用いて、血管形成におけるRunx1とそれによりmRNA発現低下するInsulin-like growth factor binding protein-3 (IGFBP-3)の役割を解析した。AEL-DR1細胞にドキシサイクリン誘導ベクター(LRT-Runx1)を用いてRunx1を再発現させると、細胞増殖が部分抑制され、マトリゲル上での管腔形成能が高進した。このときAEL-DR1/LRT-Runx1細胞の培養上清中のIGFBP-3分泌量はドキシサイクリン添加によって半減していた。次に、IGFBP-3組換え体をドキシサイクリンとともに培地に添加したところ、量依存的にAEL-DR1/ LRT-Runx1細胞のマトリゲル管腔形成率が低下した。IGFBPファミリー6遺伝子の中で、IGFBP-3とIGFBP-6だけがAEL-DR1細胞に発現していたが、IGFBP-6には管腔形成阻害活性は検出されなかった。Runx1によるmRNA発現抑制と合致して、IGFBP-3遺伝子の転写開始部位上流のゲノム領域には、Runx1のコンセンサス認識配列候補が4ヶ所存在し、最も近位のDNA配列にRunx1は結合し、転写を抑制した。以上の実験事実から、Runx1は血管ネットワーク形成を阻害するIGFBP-3の転写を負に制御することにより、血管分化をサポートすることが示された(下図)。
発表論文(中山由紀 研究員ら)2004年5月
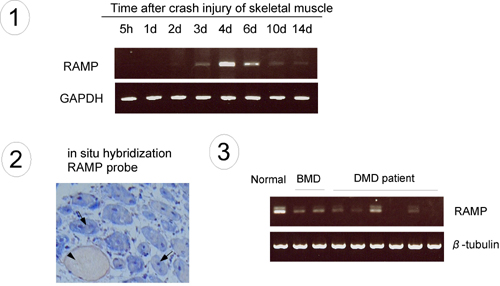
Y. Nakayama, N. Nara, Y. Kawakita, Y. Takeshima, M. Arakawa, M. Katoh, S. Morita, K. Iwatsuki, K. Tanaka, S. Okamoto, T. Kitamura, N. Seki, R. Matsuda, M. Matsuo, K. Saito, and T. Hara. Cloning of cDNA Encoding a Regeneration-associated Muscle Protease Whose Expression is Attenuated in Cell Lines Derived from Duchenne Muscular Dystrophy Patients. Am. J. Pathol., 164: 1773-1782, 2004.
(内容紹介)ジストロフィン欠損型筋ジストロフィーの病態進行に関与する遺伝子発現の違いを明かにすることを目的として本研究をおこなった。まず、筋ジストロフィーモデルマウスMdxと正常マウスとからそれぞれ骨格筋細胞株を樹立し、マイクロアレイ解析により両者でmRNA発現量の異なる遺伝子群を同定した。その中で、RAMPプロテアーゼと名付けた新規分泌性プロテアーゼをコードするmRNAの発現は正常と比べ、Mdx筋で上昇、Mdx筋細胞株で低下していた。RAMP mRNAは筋損傷後3~6日で特異的に誘導され(下図1)、しかも再生筋に限局していた(下図2)。次に、ベッカー型およびデュシャンヌ型筋ジストロフィー患者の筋生検細胞からも細胞株をそれぞれ樹立してRAMP遺伝子の発現をを調べたところ、筋ジストロフィー患者細胞株8例でそのmRNA発現はいずれも低下していた(下図3)。以上の結果から、RAMPプロテアーゼは筋再生に関与しており、その発現低下が筋ジストロフィーの進行に何らかの役割を果たしている可能性が示唆された。
発表論文(田村浩、岡本士毅 研究員ら)2002年8月
H. Tamura, S. Okamoto, K. Iwatsuki, Y. Futamata, K. Tanaka, Y. Nakayama, A. Miyajima, and T. Hara. In vivo differentiation of stem cells in the aorta-gonad-mesonephros region of mouse embryo and adult bone marrow. Experimental Hematology 30: 957-966, 2002.
(内容紹介)GFPトランスジェニックマウスの胎生11.5日胚AGM領域からCD45陰性細胞群を分離しbusulfan処理した新生マウスに移植すると、ドナー由来の血液細胞を安定に保持する造血系キメラマウスができる。移植して2-6ヶ月後、キメリズムの高いマウスの臓器を摘出し凍結切片を作製した。共焦点蛍光顕微鏡で観察した結果、GFP陽性細胞は肝臓、肺、腎臓、小腸、子宮に高頻度で分布していた。それらの一部はvWF因子やPECAM1を発現する血管内皮細胞を構成していた。またアルファアクチンを発現する平滑筋細胞にも分化していたが、どのマーカーも発現していないCD45陰性のGFP陽性細胞が小腸や子宮の間質層において高頻度に認められた。同様のin vivo分化は、造血幹細胞が高度に濃縮されたCD45陽性の骨髄SP細胞(Hoechst33342を排出する活性をもつある分画)を新生マウス肝に移植した場合にも観察された。また、放射線照射した成獣マウスに骨髄細胞を尾静脈注射した場合にも同様のin vivo分化がおこったので、胎生期AGM領域へマンジオブラストおよび成体骨髄幹細胞は、血液循環を通じて各臓器へと移行してCD45陰性の血管系細胞あるいは間質系細胞へと分化転換したと考えられる。一方、GFPトランスジェニックマウスのAGM領域あるいは骨髄幹細胞を移植したキメラマウスの大脳を詳細に観察したが、GFP陽性細胞は極めて稀にしか検出されなかった。骨格筋や心臓でも同様であったので、AGM/骨髄幹細胞のin vivo分化には臓器特異性があると推察される。
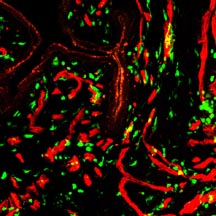
GFPマウスAGM幹細胞キメラマウスの子宮凍結切片を抗PECAM1抗体(赤)で染色した。
発表論文(田中貴代子 主任研究員ら)2002年6月
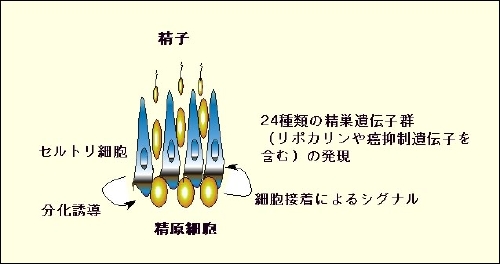
K. Tanaka, H. Tamura, H. Tanaka, M. Katoh, Y. Futamata, N. Seki, Y. Nishimune, and T. Hara. Spermatogonia-dependent expression of testicular genes in mice. Developmental Biology 246: 466-479, 2002.
(内容紹介)精原細胞に特異的な遺伝子群あるいは精原細胞による遺伝子制御情報を得るために、精原細胞が蓄積しているJSDマウスと精原細胞のほとんど存在しないW/Wvマウスの精巣の遺伝子発現をマウスcDNAマイクロアレイとRDA法を用いて網羅的に比較解析した。その結果、24種類の遺伝子群(未知遺伝子4種類を含む)がJSDマウス精巣にのみ発現ていることを見出した。これらには精巣の成熟に必要なビタミンAの輸送に関わるリポカリン群や、精巣細胞の無秩序な増殖を抑制する機能が予想されるSui1やPTP-TD14などの癌抑制遺伝子が含まれていた。これらの遺伝子群は滞留睾丸手術をした場合でも発現昂進していたため、JSD変異による発現異常ではない。さらに、これらの遺伝子群すべてが精原細胞だけでなくそれを取り巻くセルトリ細胞でも発現していることを証明した。したがって精巣の初期形成段階では、幹細胞である精原細胞からそれ自身とそれを取り巻く支持細胞の増殖・分化・成熟を制御する何らかの因子が放出されていることが示唆される。この研究により精巣形成に関与する多くの遺伝子群の同定と同時に、それらの発現が精原細胞によって統括的に支配されていることを明らかにした。