Menu

Ishida H, Miyashita M, Oshima K, Kawakami I, Sekiyama K, Kounoe M, Seki E, Arai N, Takizawa S, Nagata E, Itokawa M, Arai M. Carbonyl stress-sensitive brain regions in the patient with treatment-resistant schizophrenia with a glyoxalase 1 frameshift mutation: Autopsy study.Psychiatry Res Case Rep. in press.
https://doi.org/10.1016/j.psycr.2022.100064
これまでに私たちは慢性腎臓疾患や糖尿病を合併していない統合失調症患者の末梢血を調べ、その約4割にAGEs(advanced glycation end-products;終末糖化産物)の一つであるペントシジンが高値を示す亜群の存在を明らかにし[1]、臨床特徴との関連[2]やウェクスラー成人知能検査における処理速度の低下と相関を報告してきた[3]。しかし、末梢血ペントシジンと臨床症状の関連性が示唆された反面、ペントシジンが中枢神経系にも蓄積しているのかは未解明であり、統合失調症の病態の中核である脳機能障害との関連は不明であった。そこで本研究では、この統合失調症の亜群を見出す契機となった発端症例の死後脳を解析し、ペントシジン蓄積部位を明らかにすることによって、この亜群における脳機能障害仮説の導出を目指した。
ペントシジンを含むAGEsは、認知症患者死後脳の海馬や糖尿病患者の血管内皮細胞に蓄積していることが指摘されてきた[4]。しかし本症例では、海馬を含む内側側頭葉の神経変性は軽度であり(図1b)、ペントシジンの蓄積は認められなかった(図1f)。認知症やその他の神経疾患において病変が確認されることが多い扁桃体、側坐核、青斑核、黒質には、変性およびペントシジン蓄積は認められなかった。大脳皮質のペントシジン陽性細胞は、側頭連合野と背外側前頭前野(図1d, e)に認められたが、前部帯状回および中心前回(一次運動野)には認められなかった。特に顕著なペントシジン蓄積は一次視覚野(図1g)や頭頂葉連合野、小脳皮質(図1h)や橋核、下オリーブ核、大脳基底核(図1i)に認められた。
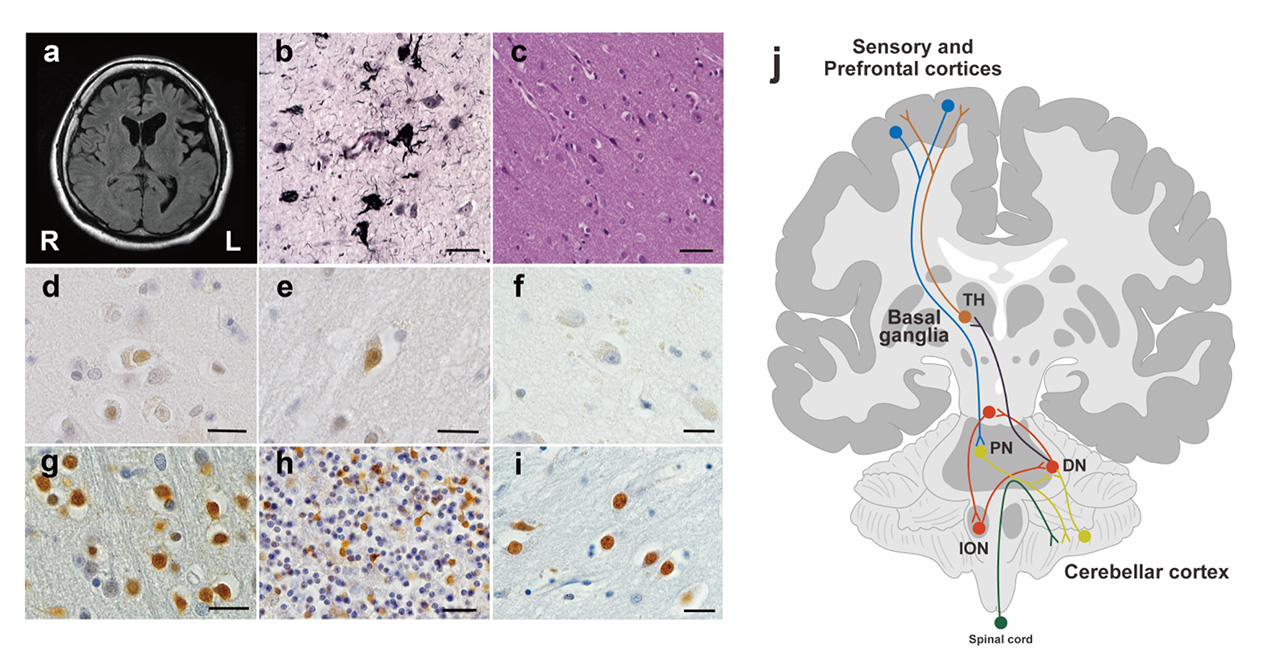
本症例は生前のMR画像にて左前頭葉および左外側溝周辺部に軽度の萎縮を認めたが(図a)、死後脳では内側側頭葉嗅内皮質に限局した神経原線維変化(図b)と側頭葉連合野に軽度の虚血性神経変化を認めたのみで、重度の神経脱落や変性は認められなかった(図c)。ペントシジンは、側頭葉連合野(図d)と背外側前頭前野(図e)の錐体細胞内に蓄積を認めた。さらに一次視覚野第Ⅳ層(図g)、小脳皮質顆粒細胞層(図h)、大脳基底核淡蒼球(図i)に顕著なペントシジン陽性細胞が認められた。これらの部位にペントシジン以外の異常タンパク質の蓄積や神経変性は認められなかった。海馬(図f)、扁桃体、黒質、青斑核は神経変性がなく、ペントシジン陽性神経細胞も認められなかった。カルボニルストレス脆弱性を示す小脳−大脳基底核−大脳を結ぶ神経ネットワークの例(図j:TH;視床、PN;橋核、DN;小脳歯状核、ION;下オリーブ核)。
図2にはペントシジンが顕著に蓄積していた脳領域をまとめた。発端症例と年齢と性別をマッチさせた糖尿病腎症疾患患者、認知症患者の一次視覚野、小脳皮質、淡蒼球にはペントシジン陽性神経細胞は認められなかった(図3)。
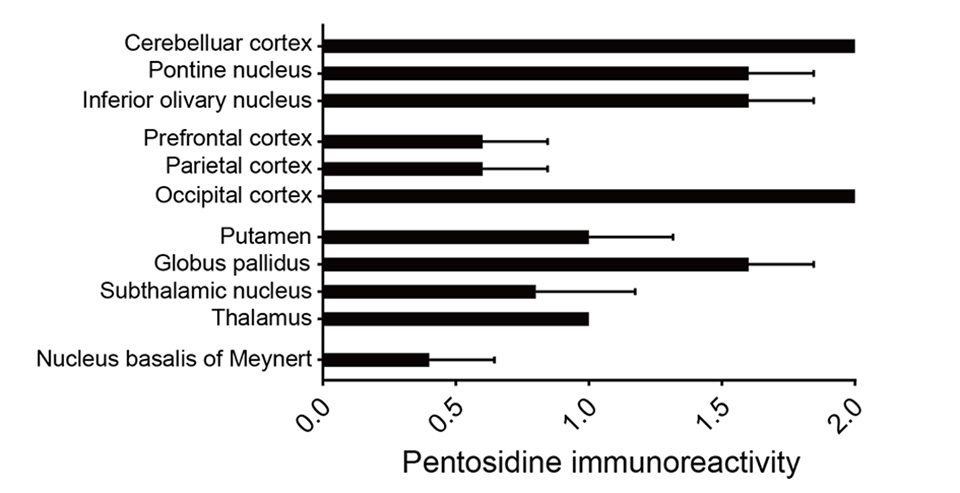
ペントシジン蓄積は、小脳系では小脳皮質顆粒細胞、橋核および下オリーブ核の神経細胞に顕著に認められた。大脳皮質内では背外側前頭前野(BA9)、頭頂葉連合野(BA40)の錐体細胞、一次視覚野(鳥距溝内)第Ⅳ層顆粒細胞に顕著に認められた。大脳基底核と視床では、被殻、淡蒼球外節、視床下核、視床の神経細胞に蓄積が認められた。大脳辺縁系ではマイネルト基底核に僅かに蓄積が認められた。
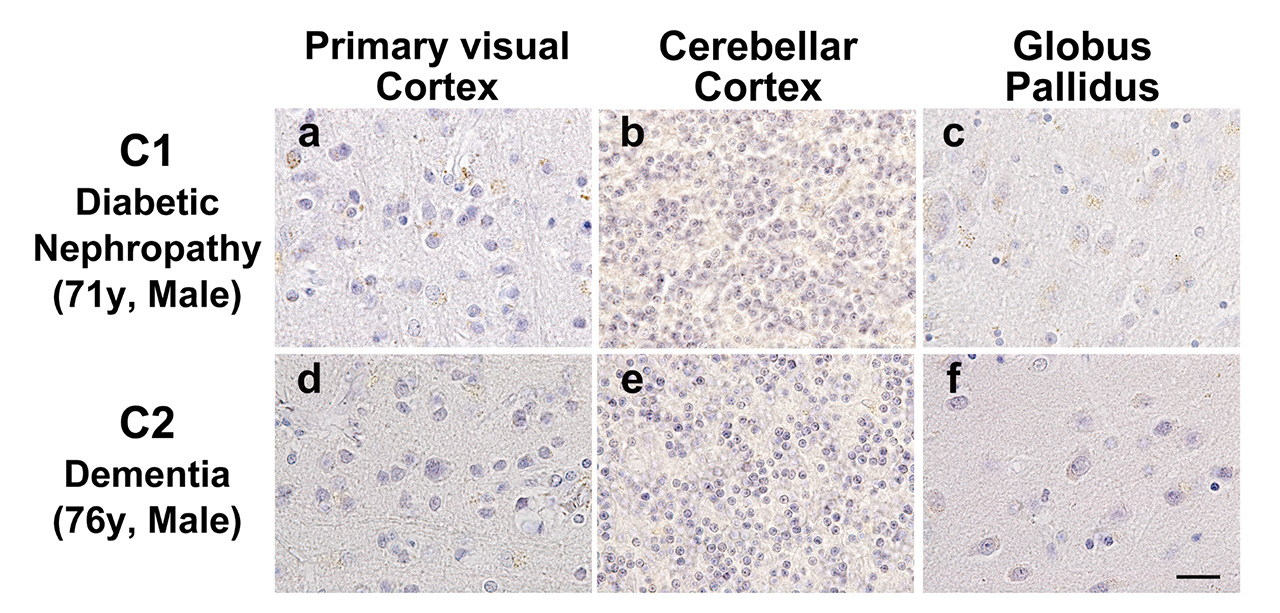
本症例と年齢と性別を一致させた糖尿病性腎症および認知症患者の死後脳では、一次視覚野(図aとd)、小脳皮質顆粒細胞(図bとe)、淡蒼球外節(図cと f)の神経細胞にはペントシジン蓄積は認められなかった。
本症例は、「カルボニルストレスが増強された統合失調症」という臨床的特徴を端的に有していた。死後脳に対してペントシジン蓄積部位を解析した結果、ペントシジン蓄積が顕著に認められた脳領域は、小脳−大脳基底核−大脳(前頭前野、頭頂連合野、側頭連合野、一次視覚野)であった。本研究によって、カルボニルストレスが蓄積しやすい脳部位と神経ネットワークの一端が示された。今後は、ペントシジン等のAGEs蓄積がもたらす脳機能障害のメカニズムを解明に着手し、統合失調症の原因解明と治療法開発に役立つ研究を進めていきたい。