老化や寿命、アンチエイジングなど、
身近な問題とも関わりが!
酵母や線虫などの単純なモデル生物での実験では、プロテアソームの機能が低下すると、細胞の分裂回数が減り、寿命は短くなることがわかっています。
逆に、プロテアソームの量を増やす実験では、寿命が少し長くなるという結果が出ています。プロテアソームは、細胞の寿命や老化、アンチエイジングとも関係があるのです。
プロテアソームの機能は、細胞の外的・内的ストレスにも影響されます。肥満がプロテアソームの機能の低下を招き、メタボリックシンドロームなどさまざまな生活習慣病を引き起こすという研究結果もあります。体のあらゆることがプロテアソームと関係しているのです。
2020年2月6日
当研究室の安田さや香研究員、土屋光研究員、田中啓二理事長、佐伯泰副参事研究員らは、細胞が環境ストレスに適応するための新しいタンパク質分解の仕組みについて発表しました。
液-液相分離が担う核内タンパク質分解機構の発見
~細胞が環境ストレスに適応するための新しいタンパク質分解の仕組み~
研究の背景
現在、世界の生命科学分野で注目されているキーワードとして「液-液相分離」という現象があります。これは2つの液体が混ざり合わずに互いに排除しあうことで2つの相に分離する現象のことです。身近な例では、サラダドレッシングが水と油の2相に分かれる状態も液-液相分離で、自然界ではよくみられる現象です。最近の研究により、細胞内でも核酸やタンパク質が液-液相分離を起こして周囲とは異なる液相を形成し、水に浮かぶ油滴のように液滴を形成することが分かってきました。細胞内には核やミトコンドリア等の「膜で仕切られたオルガネラ(細胞小器官)」があることはよく知られていますが、タンパク質をはじめとする生体高分子の液滴は「膜のないオルガネラ」として、様々な役割を担っていることが明らかになりつつあります。
他方、生物の重要な構成成分の一つであるタンパク質は、生体内のシステムによりその品質を厳密に管理されており、正常な合成と分解のサイクルによって、恒常性が維持されています。細胞内タンパク質代謝における主要な担い手であるユビキチン・プロテアソーム系*1)ユビキチン・プロテアソーム系*1)
オートファジー・リソソーム系と並ぶ細胞内の主要なタンパク質分解系であり、ユビキチン化されたタンパク質をプロテアソームが選択的に分解することで、細胞増殖やシグナル伝達、タンパク質の品質管理等、様々な細胞機能を制御する。は、異常タンパク質や役目を終えた機能性のタンパク質を選択的に分解除去することで、タンパク質の恒常性の維持のみならず遺伝子発現、ストレス応答、シグナル伝達等、様々な細胞機能の制御に必須の役割を果たしています。近年、細胞質に存在するタンパク質やオルガネラの分解経路が次々と明らかになってきている一方、核内におけるタンパク質の分解の仕組みは未だ解明されていない部分が多く残されています。
研究の概要
今回、プロテアソーム*2)プロテアソーム*2)
ユビキチン化タンパク質を分解するエネルギー依存性の巨大な酵素複合体。プロテアソームの異常はさまざまな疾患や老化と関与することが示唆されている。の細胞内での振る舞いを調べるため、蛍光顕微鏡を用いた解析を進めていたところ、プロテアソームが高浸透圧のストレスに応答して核内で粒状の構造体をつくることを見出しました。この構造体はユビキチン化されたタンパク質を含み、プロテアソームを阻害すると肥大化したため、ユビキチン化タンパク質を集めて分解する場所であることが分かりました。
この構造体の性状を詳細に調べたところ、核内で動き回っていること、ほぼ球状であること、互いに融合して大きくなることが分かり、液-液相分離により形成する新しい細胞内液滴であることが分かりました (図1) 。
続いて、プロテアソーム液滴の構成分子を探索したところ、ユビキチン化タンパク質をプロテアソームに運ぶタンパク質RAD23B*3)RAD23B*3)
プロテアソームおよびユビキチン鎖と結合するドメインを持ち、ユビキチン化タンパク質をプロテアソームに運ぶシャトル分子として機能する。近年、プロテアソームに依存したタンパク質分解に大きく寄与していることが明らかとなってきた。が集積していることが分かりました。RAD23Bをノックアウトした細胞ではプロテアソーム液滴は形成しなかったため、RAD23Bはプロテアソーム液滴の形成に必要な分子であることが分かりました。さらに変異体を用いた解析により、RAD23Bはユビキチン化タンパク質を集める機能をもつことが示唆されました。そこで、精製したユビキチン鎖*4)ユビキチン鎖*4)
ユビキチンは76アミノ酸の小さなタンパク質であり、標的となるタンパク質に共有結合(ユビキチン化)することで、標的タンパク質の量や局在などを制御する翻訳後修飾子である。ユビキチン自身もユビキチン化されることで、ユビキチン鎖を形成し、主にプロテアソームによる分解の目印となる。とRAD23Bを試験管内で混合し観察したところ、ユビキチン鎖とRAD23Bを含む液滴が形成しました。つまり、まずユビキチン鎖とRAD23Bの相互作用によって液-液相分離が誘導され、そこへプロテアソームが動員されることでプロテアソーム液滴が生じることが明らかとなりました (図2) 。
一方、プロテアソーム液滴はユビキチンに選択的なシャペロンであるp97*5)p97*5)
AAA+タイプの六量体リング構造を持ったATPase。様々な補因子とともに働き、ユビキチン化された標的タンパク質を解きほぐす機能を持つ。p97はALSや封入体筋炎などのタンパク質凝集病に関与することがしられている。も含んでおり、p97はプロテアソームと協調して、ユビキチン化タンパク質の分解を誘導することがわかりました。また、プロテアソーム液滴が形成しないと、細胞は高浸透圧ストレスに感受性になり、細胞死が強く誘導されることがわかりました。つまり、プロテアソーム液滴は、細胞が環境ストレスに適応するために形成する、新たなタンパク質分解の仕組みの一つであることが明らかになりました。
社会的意義と今後の展望
近年、液-液相分離は新たな細胞内現象として大いに注目を集めていますが、今回の研究により、ユビキチン・プロテアソーム系による核内タンパク質の品質管理機構とも関連していることが明らかになりました。これは、液-液相分離が細胞内における現象に広く関与していることを改めて示すもので、液-液相分離の視点から細胞内の様々な現象の見直しが進むことが予想されます。
また、凝集性のタンパク質の集積は、神経変性疾患の発症や進行に関係していると考えられています。従って、タンパク質の分解という品質管理の分子機構の一端を明らかにした今回の研究成果は、タンパク質分解の異常が引き起こす細胞のがん化や神経変性疾患を抑えるための知見の基盤になると期待されます。
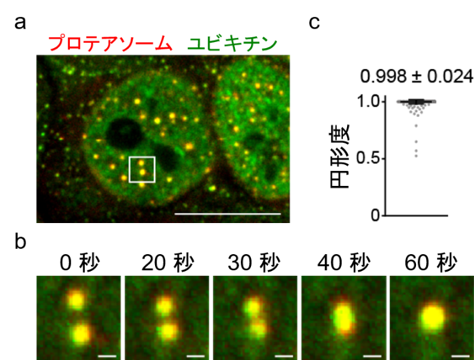
- 赤色蛍光タンパク質をプロテアソームに、緑色蛍光タンパク質をユビキチンに融合し、ノックインした細胞。細胞に高浸透圧のストレスを与えると、核内で顕著に液滴が形成される。この液滴にはプロテアソームとユビキチンが存在するため、両者が重なって黄色に見える。共焦点蛍光顕微鏡で観察 (スケールバー:10 µm)。
- 液滴が融合し大きくなる様子。(a) 内の白四角を拡大 (スケールバー:0.5 µm)。
- 個々の液滴の円形度を算出してグラフに示した。値が1に近づくほど粒子は真円に近づく。数値は液滴1,312個の平均値±SD(標準偏差)。
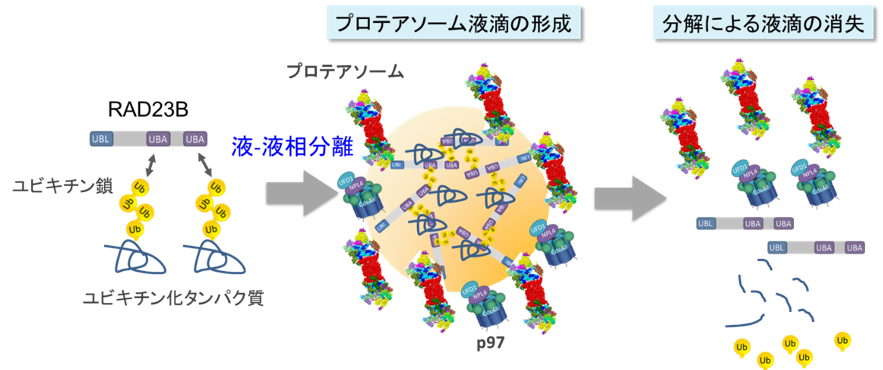
高浸透圧のストレスにより生じたユビキチン化基質(タンパク質)がRAD23Bと液-液相分離し、さらにプロテアソームを呼び込むことでプロテアソーム液滴が形成される。プロテアソームによるユビキチン化タンパク質の分解により液滴は消失する。
用語説明
- *1)ユビキチン・プロテアソーム系:
- オートファジー・リソソーム系と並ぶ細胞内の主要なタンパク質分解系であり、ユビキチン化されたタンパク質をプロテアソームが選択的に分解することで、細胞増殖やシグナル伝達、タンパク質の品質管理等、様々な細胞機能を制御する。
- *2)プロテアソーム:
- ユビキチン化タンパク質を分解するエネルギー依存性の巨大な酵素複合体。プロテアソームの異常はさまざまな疾患や老化と関与することが示唆されている。
- *3)RAD23B:
- プロテアソームおよびユビキチン鎖と結合するドメインを持ち、ユビキチン化タンパク質をプロテアソームに運ぶシャトル分子として機能する。近年、プロテアソームに依存したタンパク質分解に大きく寄与していることが明らかとなってきた。
- *4)ユビキチン鎖:
- ユビキチンは76アミノ酸の小さなタンパク質であり、標的となるタンパク質に共有結合(ユビキチン化)することで、標的タンパク質の量や局在などを制御する翻訳後修飾子である。ユビキチン自身もユビキチン化されることで、ユビキチン鎖を形成し、主にプロテアソームによる分解の目印となる。
- *5)p97:
- AAA+タイプの六量体リング構造を持ったATPase。様々な補因子とともに働き、ユビキチン化された標的タンパク質を解きほぐす機能を持つ。p97はALSや封入体筋炎などのタンパク質凝集病に関与することがしられている。