このページを印刷
TOPICSへ
未来を話そう!
プロジェクト研究の紹介
認知症プロジェクト
アルツハイマー病などの変性性の認知症が、どのように起こり、どう進むのかを研究しています

超高齢化が進む日本では、認知症対策が急務です。認知症は、血管の障害から起こる血管性の認知症と、神経細胞の変性が進んで起こる変性性の認知症に大別されます。認知症の多くを占める後者については、病気の原因や対策が、いまだによくわかっていません。私たちのプロジェクトでは、そうした変性性の認知症の発症・進行のメカニズムについて研究しています。
認知症プロジェクト
長谷川 成人 プロジェクトリーダーが解説します。
Masato HASEGAWA
Project Leader

認知症プロジェクト
長谷川 成人 プロジェクトリーダーが解説します。
Masato HASEGAWA
Project Leader
どんなことに役立つの?
現在、アルツハイマー病をはじめとする変性性の認知症に対しては、十分に有効な治療薬が開発されていません。変性性の認知症の発症・進行のメカニズムについての研究が進めば、変性性の認知症に効果的な薬の開発につながる可能性があります。パーキンソン病やALS(筋萎縮性側索硬化症)など、認知症以外の神経変性疾患への応用も期待されます。

種類と原因
変性性の認知症の原因は「異常型タンパク質」
—— 変性性の認知症にはどんなものがあるのでしょうか?
長谷川一番多いのがアルツハイマー病で、認知症全体の50〜60%を占めます。次に多いのがレビー小体型認知症、さらに前頭側頭葉変性症と呼ばれる認知症などがあります。いずれも、徐々に病状が悪くなっていく進行性の病気で、原因ははっきりとは解明されていません。
—— 変性性の認知症の人の脳では、何が起こっているのですか?
長谷川それぞれの病気の脳には、特有の異常型タンパク質が蓄積することがわかっています。この異常型タンパク質の蓄積は、単なる変性の副産物ではなく、認知症の発症や進行にも深く関係しています。
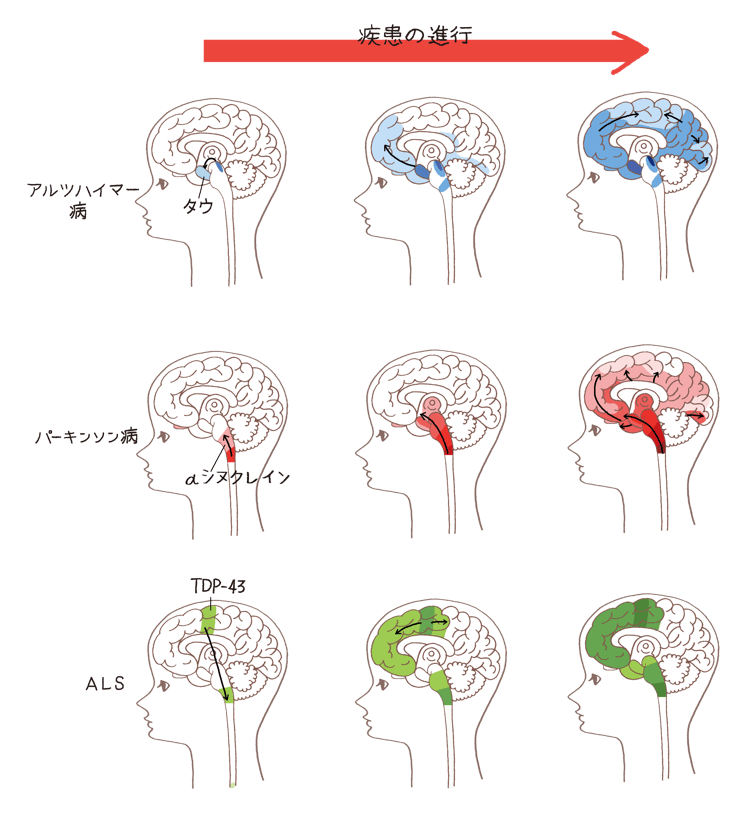
病気ごとに主要なものをあげると、アルツハイマー病では「タウ」、レビー小体型認知症やパーキンソン病では「αシヌクレイン」、前頭側頭葉変性症やALSでは「TDP-43」というタンパク質が、それぞれ異常に凝集して蓄積します。前頭側頭葉変性症には、一部、タウが蓄積するタイプもあります。
メカニズム
まず「種」ができ、以後は加速度的に異常化が進む
—— タンパク質が異常に凝集するのは、なぜですか?
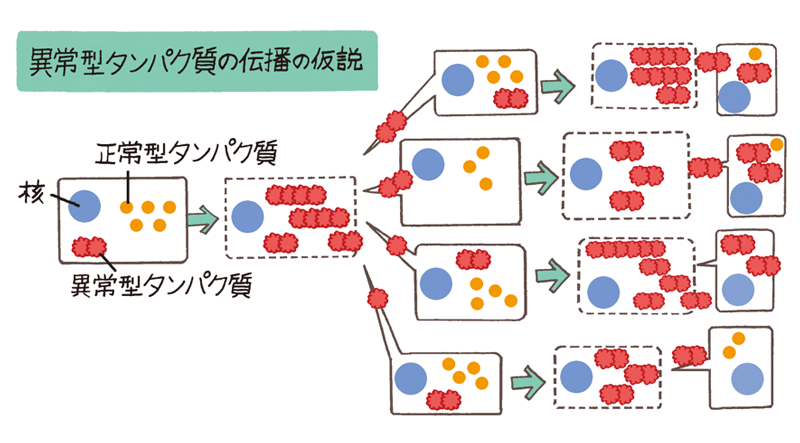
長谷川タウなどのタンパク質は、本来はそれぞれに正常な働きをしているのですが、何かのきっかけで異常型に変換し、増殖していくのです。私たちは、これらのタンパク質がどのような異常を伴って蓄積しているかを詳細に調べるとともに、それぞれのタンパク質の細胞モデルを用いた研究で、従来とはまったく違う新しい仮説を提唱しています。
それは、脳の細胞をつなぐ回路や連絡路を介して、異常型タンパク質が細胞間を移動し、自分自身を鋳型に自己複製しながら、がん細胞のように、細胞から細胞へと伝播して広がっていくという考え方です。つまり、1カ所から異常が始まり、徐々に広がって進行するというものです。
—— 異常型タンパク質が蓄積する仕組みは?
長谷川私たちは、まずタンパク質の複数の分子が結合して、タンパク質の異常化の「種」(「重合核」)ができると考えています。種は、20〜30代から、生じては体の防衛機構で壊されることをくり返すと考えられます。最初の種ができるまでは長い時間がかかりますが、いったん種ができてしまうと、それが周囲の正常型タンパク質を取り込んで異常化させます。種ができたあとは異常型タンパク質が加速度的に増えると考えられます。
未来への展望
効果的な治療薬の開発に
つながる検証実験に成功
—— 仮説の検証はどこまで進んでいるのでしょうか?
長谷川病原性のタンパク質としては、一時期、狂牛病との関連で有名になったプリオンがあります。しかし、プリオンはそれ自体をきれいに取り出すことが難しく、「本当にタンパク質だけが原因なのか」という検証が完全にはできていませんでした。
私たちは、大腸菌で作らせたヒトαシヌクレインを試験管の中で異常型に変換し、純粋なタンパク質だけからなる試料をマウスの脳内に接種しました。その結果、マウスの脳内の正常なαシヌクレインが異常化し、急速に増殖することが証明されたのです。微量の異常型タンパク質が脳内に存在するだけで病気が起こることが明らかになりました。
—— 新たな治療薬の開発にもつながりますか?
長谷川この実験でもう一つ画期的なのは、遺伝子改変していない普通のマウスで成功したことです。世界中でアルツハイマー病治療薬の治験が行われていますが、いまだにうまくいかないのは、ほとんどが異常型タンパク質を過剰発現するマウスの薬効評価をもとにしていることが理由の一つと考えられます。
私たちは、今後もさらに変性性の認知症の発症や進行のメカニズムを解明していくことで、その予防や治療戦略も明確になると考えています。そして、これまでの治療薬とはメカニズムが異なる、病気の進行を止める薬剤の探索、開発を進めています。

筋萎縮性側索硬化症など、
他の難病の治療にもつながる可能性が

前頭側頭葉変性症という認知症で、脳内にたまるのは異常型のTDP-43というタンパク質ですが、これが脊髄などに蓄積するとALS(筋萎縮性側索硬化症)が起こります。また、レビー小体型認知症の原因物質である異常型のαシヌクレインが脳幹などにたまるとパーキンソン病が起こります。
このように、原因物質の判明により、従来は症状で分類していた病気を原因物質によって分けられるようになってきました。
変性性の認知症に関する研究が進むことは、原因物質が共通する認知症以外の神経変性疾患の治療法の開発にもつながります。神経変性疾患には現状では治療法がない難病が多いだけに、この分野の進展が期待されます。
<< 参考動画 >>
生命科学連携推進協議会チャンネル
生命科学4プラットフォーム 支援利用者インタビュー ![]()
2020年7月22日
認知症プロジェクトの鈴木元治郎主席研究員、長谷川成人参事研究員らは、構造の異なるαシヌクレイン線維は、プロテアソーム*1)阻害の違いにより異なる病理を誘導することについて発表しました。
構造の異なるαシヌクレイン線維は、
プロテアソーム阻害の違いにより異なる病理を誘導する
研究の背景
アルツハイマー病をはじめとする神経変性疾患では、患者の死後脳を調べると、多くの場合、その病気に特徴的なタンパク質の線維状凝集体の蓄積が見られます。パーキンソン病、レビー小体型認知症や多系統委縮症等では、αシヌクレイン(αSyn)と呼ばれるタンパク質の線維状凝集体の蓄積が観察され、これらの疾患はαシヌクレイノパチーと呼ばれます。凝集体が蓄積する部位と神経変性が起きる部位が密接に関わりあっていること、αSyn遺伝子に変異が生じることで発症することから、αSyn凝集体自身がαシヌクレイノパチーの原因であると考えられます。しかし、αSyn凝集体が原因であるのであれば、αSyn凝集体にどのような毒性があるのか?αSyn凝集体によって異なる疾患が引き起こされるのはなぜか?などはわかっていませんでした。
研究の概要
近年の研究から、パーキンソン病、レビー小体型認知症、多系統委縮症の患者の死後脳に蓄積しているαSynの線維状凝集体の構造は、それぞれ異なることが明らかになってきました。そこで、我々は大腸菌を用いて精製した可溶性のαSynタンパク質を使って、異なる条件の元で線維状凝集体を形成しました。αSynの線維状凝集体を、塩化カリウム(KCl)の非存在下(αSyn凝集体KCl-)と生理的条件の塩化カリウムの存在下(αSyn凝集体KCl+)で形成し、この二つの凝集体が異なる構造を持つことを確認しました。
次に、これらの凝集体を野生型マウスの脳内に注入したところ、前者(αSyn凝集体KCl-)を注入したマウスでは、αシヌクレイノパチーと同様に、リン酸化*2)したαSyn凝集体の蓄積が顕著に認められましたが、一方、後者(αSyn凝集体KCl+)を注入したマウスでは、αSyn凝集体の蓄積はほとんど認められませんでした(図1)。
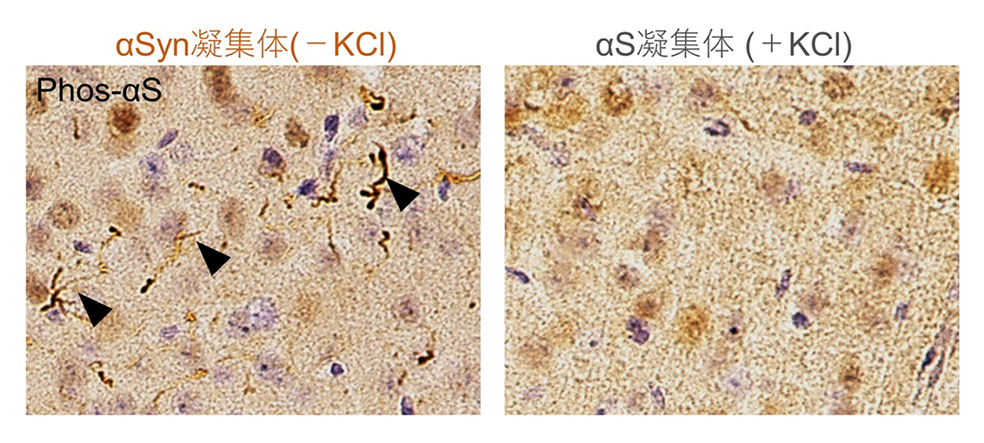
マウスの脳内にそれぞれのαSyn凝集体を注入し、一か月後に現れたリン酸化αSyn凝集体の蓄積。αSyn凝集体(-KCl)を注入したマウス脳内では、顕著なリン酸化αSyn凝集体の蓄積(矢頭)が認められたが、αSyn凝集体(+KCl)を注入したマウス脳内ではほとんど認められなかった。
次に、これらの凝集体を培養した神経細胞に導入したところ、マウスの脳内に注入した時と同様に、前者(αSyn凝集体KCl-)を注入した神経細胞でのみ、リン酸化したαSyn凝集体の蓄積が顕著に認められました。また、αSyn凝集体KCl-を導入した神経細胞では、ユビキチン化したタンパク質が蓄積していました。ユビキチン化したタンパク質はプロテアソームにより分解されることから、αSyn凝集体KCl-はプロテアソーム活性を阻害するのではないかと考えました。そこで、精製したプロテアソームのタンパク質分解活性を、それぞれのαSyn凝集体の存在下で計測したところ、αSyn凝集体KCl-の存在下でのみ、プロテアソームのタンパク質分解活性が低下することがわかりました。また、αSyn凝集体KCl-のみが、精製したプロテアソームと相互作用することがわかりました。
続いて、これらのαSyn凝集体の構造のどの部分が異なるかを質量分析により解析したところ、αSyn凝集体KCl-では、αSyn凝集体KCl+よりも、αSynのC末端領域が露出していることがわかりました。そこで、C末端領域を欠いたαSyn(αSynΔC)を精製し、塩化カリウムの非存在下で凝集体を形成し、得られた凝集体(αSynΔC凝集体KCl-)を培養した神経細胞に導入したところ、リン酸化したαSyn凝集体の蓄積はほとんど認められませんでした。また、SynΔC凝集体KCl-は、プロテアソームと相互作用せず、活性も阻害しませんでした。αSynのC末端領域はマイナスに荷電していることから、塩化カリウムなどの塩の存在の有無により、C末端領域の電荷に変化が生じ、異なる構造のαSyn凝集体が形成され、露出したC末端領域を持つαSyn凝集体がプロテアソームの活性を阻害すると考えられます(図2)。
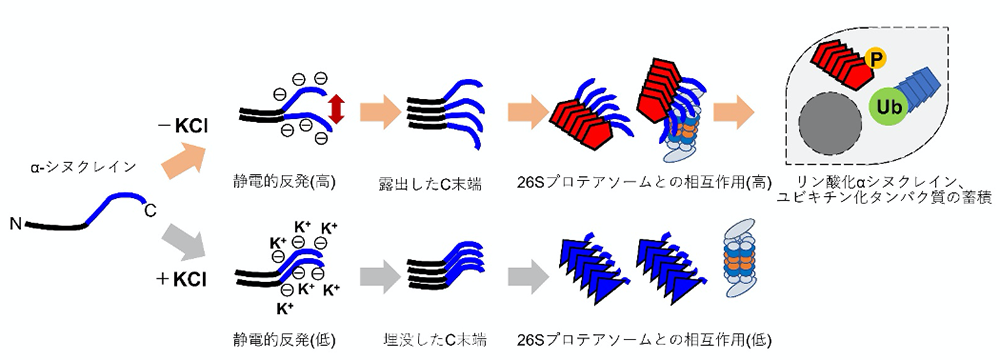
αSynはC末端領域に負に荷電した領域(青)がある。塩化カリウム(KCl)の非存在下で凝集体を形成すると、C末端領域の静電的反発により、C末端領域が露出した構造の凝集体が形成される。この凝集体の露出したC末端領域がプロテアソームと相互作用し、その活性を阻害すると考えられる。このような構造の凝集体をマウスや細胞に導入すると、リン酸化αSynの蓄積やユビキチン化タンパク質の蓄積が誘導される。一方、塩化カリウムの存在下で凝集体を形成すると、静電的反発が抑えられ、C末端領域が埋没した構造の凝集体が形成される。この凝集体はプロテアソームと相互作用をせず、その活性も阻害しないと考えられる。
今回の結果から、αSyn凝集体の毒性はその構造により異なり、プロテアソームの活性を阻害する毒性をもつ構造のものが存在することが明らかになりました。また、αSynの構造の違いにより引き起こされる病理が異なることの原因が明らかとなり、今後αシヌクレイノパチーの発症メカニズムの解明につながることが期待されます。
用語解説
- *1)プロテアソーム:
- ユビキチン化タンパク質を分解するエネルギー依存性の巨大な酵素複合体。プロテアソームの異常は様々な疾患や老化と関与することが示唆されている。
- *2) リン酸化:
- タンパク質の機能面での調節や、細胞全体のシグナル伝達において主要なメカニズムを担う化学反応で、生物にとって重要な調節機構である。