細胞の中はどうなっているの?
オルガネラとは何?
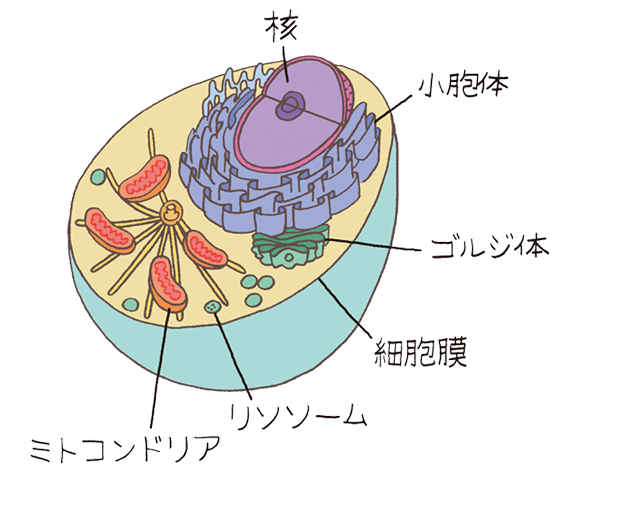
生物の最小単位である細胞は、細胞膜で覆われた中にさまざまなものがぎっしり入っています。
細胞は大まかには核と細胞質に分かれます。核にはDNAが折り畳まれた染色体などが入っており、DNAには遺伝情報が書き込まれています。
細胞質の中で一定の機能を持っている小部屋がオルガネラ、別名 細胞小器官と呼ばれています。パーキンソン病に関わりがあるのが、酸素を使ってエネルギーを作るミトコンドリア、そしてユビキチンと協力して細胞内の消化を行うリソソームです。
このほかに、物質の輸送の出発点となる小胞体、分泌の行き先を仕分けるゴルジ体などで構成されています。
2021年6月29日
ユビキチンプロジェクトの吉田雪子主席研究員、松田憲之プロジェクトリーダー、田中啓二理事長らは、ヒトの希少遺伝疾患であるNGLY1欠損症の発症メカニズムを明らかにしました。今回の研究成果は、NGLY1欠損症の治療法の開発につながるものと期待できます。
ヒト希少遺伝疾患「NGLY1欠損症」発症機構の解明〜治療法開発への第一歩〜
発表のポイント
- これまで発症のメカニズムがわからず、治療法もなかった重篤な希少遺伝疾患「NGLY1欠損症」の発症メカニズムを解明しました。
- 糖タンパク質からN型糖鎖を外す酵素NGLY1の遺伝子を破壊したマウスは、発生期に異常が生じ、生まれてきません。しかし、このNGLY1遺伝子と、FBS2の遺伝子を同時に破壊した二重変異マウスは、正常に発育することを発見しました。FBS2は糖鎖を認識して分解シグナルであるユビキチン鎖を付加する酵素です。
- NGLY1を作ることができない細胞にFBS2を発現させると、糖鎖とユビキチン鎖がついたままの異常なタンパク質が細胞中に溜まり、細胞死を起こすことがわかりました。
- 細胞の中に蓄積した異常なユビキチン化糖タンパク質は、生命の維持に必須なタンパク質分解装置プロテアソームの機能不全を引き起こすことを発見しました。
研究の背景
NGLY1(細胞質ペプチド:N-グリカナーゼ)は、細胞質内でタンパク質のN型糖鎖*1)を根元から切断する酵素で、身体の中で間違って合成され、構造が異常になったタンパク質の除去に関わっています*2)。2012年、エクソーム分析によってNGLY1欠損症の患者が海外で発見されました。NGLY1欠損症は、発育不全、四肢の筋力低下、不随意運動、てんかん、脳波異常、無涙症、新生児の肝機能障害等を引き起こす重篤な疾患ですが、未だ発症の詳細なメカニズムの解明や治療法の開発は道半ばです。
研究の内容
N型糖鎖を持つ糖タンパク質の糖鎖は、一般的には細胞の外側、あるいは細胞内小器官の膜の内側を向いているため、細胞質側には存在しません。しかし、細胞質には、脱糖鎖酵素NGLY1と共に糖鎖に結合して、プロテアソームによる分解を引き起こすシグナルとなるユビキチン鎖*3)をつける酵素が複数存在します(図1)。私たちは、NGLY1遺伝子が欠損したマウスに、この糖鎖認識ユビキチン付加酵素*4)のひとつのFBS2の遺伝子を同時に欠損させると、胚性致死を回復させ、ほぼ正常に生育することを見出しました(図2)。つまり、NGLY1のない状態ではFBS2が生体に異常を引き起こす可能性があると考えられます。
次に、この仮説が正しいかを調べるために、NGLY1遺伝子を破壊した培養細胞にFBS2を発現させたところ、細胞が増殖せず、そのうち細胞死を起こすことを見出しました。詳細に解析すると、NGLY1がない細胞でFBS2が働くと、分解シグナルであるはずのユビキチン鎖が異常についた糖タンパク質が細胞に溜まってしまい、プロテアソームの機能が落ちてしまうことがわかりました。プロテアソームは、細胞の増殖や恒常性の維持に欠かせない分解装置であり、うまく働かなくなると細胞は死んでしまいます。細胞にはプロテアソームの活性を維持する機構があり、プロテアソームは活性が低下すると、NRF1*5)という転写因子により新たなプロテアソームが作られるようになります。私たちはFBS2がNRF1を異常にユビキチン化することで、プロテアソームの活性回復機能を損なうことを明らかにしました(図3)。
胚性致死のNGLY1遺伝子欠損マウスの組織中では、NRF1のユビキチン化が認められましたが、NGLY1/FBS2の二重遺伝子欠損マウスではユビキチン化がみられないことからも、生体内でも同じようにプロテアソーム活性の低下が致死性を引き起こしている可能性が考えられます。
社会的意義・今後の展望
今回、NGLY1欠損症の発症メカニズムを明らかにしました。FBS2遺伝子欠損マウスは異常な表現型がなく、NGLY1がない場合にFBS2が働くことが生体に悪影響を及ぼすと考えられることから、FBS2の活性を特異的に抑制することは、NGLY1欠損症の治療につながる可能性があります。そのため、今回の研究で得られたマウスの知見がヒトにおいても同様であるかについて、今後研究を進めていく予定です。
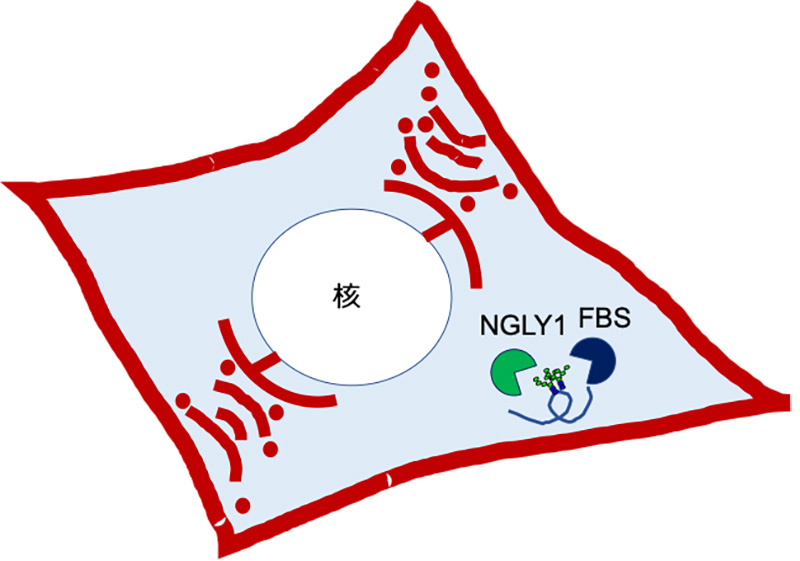
N型糖鎖を持つ糖タンパク質は、通常、赤で示す細胞膜の外や小胞体、ゴルジ体、リソソーム等の膜で囲まれた細胞内小器官内に存在する。しかし、一般的には糖鎖の存在しないはずの水色で示した細胞質には、脱糖鎖酵素NGLY1や糖鎖認識ユビキチン付加酵素サブユニットFBSが存在し、異常タンパク質として小胞体から細胞質へ戻された糖タンパク質を認識する。
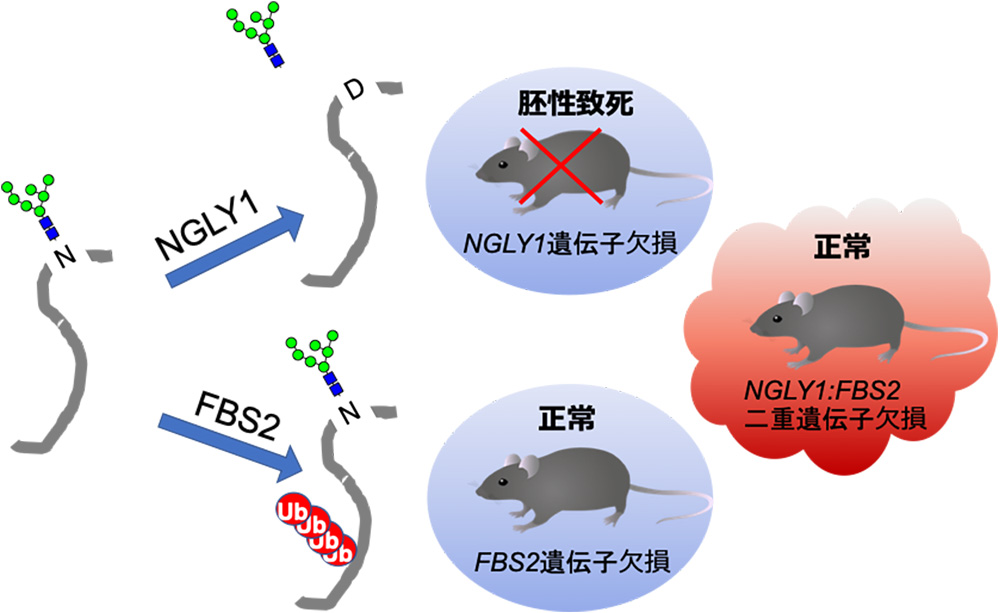
NGLY1はN型糖鎖の根元から糖鎖を取り除く。その際、デアミダーゼ*6)の反応により糖鎖の結合したアスパラギン(N)をアスパラギン酸(D)に変換する。FBS2は糖タンパク質のN型糖鎖に結合して、タンパク質部分にユビキチン鎖を付加する。NGLY1遺伝子欠損マウスは胚性致死で、FBS2遺伝子欠損マウスは正常に発育する。さらに、これらの遺伝子の二重欠損マウスは正常に生まれて発育する。
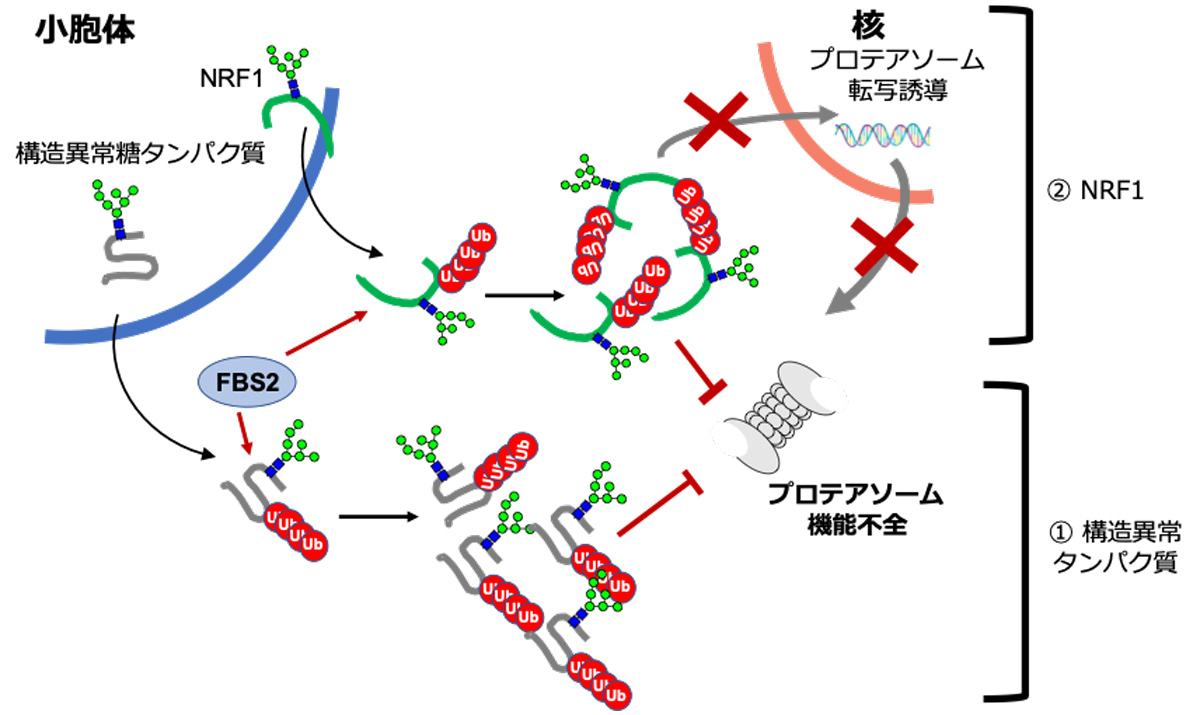
細胞が増殖していく際にある確率で生じる構造異常の糖タンパク質は、小胞体から細胞質に放出され、NGLY1で糖鎖が外され、プロテアソームで分解を受ける。しかし、NGLY1が無い場合、細胞質にN型糖鎖をもつタンパク質が蓄積し、FBS2に糖鎖が認識され、ユビキチン化が高頻度に起こる。糖鎖とユビキチンを同時に持つタンパク質の蓄積は、プロテアソームに負荷をかけプロテアソームの機能に阻害がかかる。プロテアソームが阻害されると、通常はNRF1が小胞体から核に移動して新しいプロテアソームを作るべく転写の誘導を行うが、FBS2によりユビキチン化されたNRF1は核に行くことができず、プロテアソームを新たに合成できない。さらに悪いことに、ユビキチン化されたNRF1もまたプロテアソームに負荷をかけ、プロテアソームは機能不全に陥り、細胞死を招く。
用語説明
- *1)N型糖鎖:
- タンパク質を修飾する糖鎖には、タンパク質との結合様式の違いにより、N型とO型のものがある。N型糖鎖をもつ糖タンパク質糖鎖は、一般的に細胞の外に存在し、細胞質には存在することは稀である。
- *2)異常タンパク質クリアランス機構:
- 糖タンパク質は、小胞体という細胞内小器官で糖鎖がつけられて、立体構造が形成されていくが、正しい構造をとれなかったものは、細胞質にあるプロテアソームという巨大複合体で分解されるという恒常性維持の機構が知られている。プロテアソームが詰まらないようにNGLY1により糖鎖が外されると考えられている。専門的には「小胞体関連分解」と呼ばれる。
- *3)ユビキチン:
- 76個のアミノ酸からなる小さなタンパク質のユビキチンは、酵母からヒトまで全ての真核生物で保存されている。鎖状に連なったユビキチン鎖は、プロテアソームによる分解の目印として機能する。
- *4)ユビキチン付加酵素:
- ユビキチンは、ヒトでは数百種類存在するユビキチン付加酵素(ユビキチンリガーゼ)がタンパク質の修飾や構造を見分けて付けられる。N型糖鎖をシグナルとしてユビキチンを付加する酵素は3種類ある。
- *5)NRF1:
- 小胞体に存在するN型糖タンパク質である。常にプロテアソームにより分解を受けていて、通常は、ほとんど細胞内に存在しない。しかし、プロテアソームの活性が弱まると、分解が抑えられて、核へ移動し、プロテアソームの合成を誘導する転写因子として働くようになる。
- *6)デアミダーゼ:
- アスパラギンやグルタミン等の酸アミドを加水分解する酵素の総称。
アスパラギン + H2O → アスパラギン酸 + NH3
グルタミン + H2O → グルタミン酸 + NH3
2021年1月26日
ユビキチンプロジェクトの小島和華外部支援研究員、山野晃史主席研究員、松田憲之プロジェクトリーダーらは、哺乳類のオートファジー経路に関わる新規因子のBCAS3-C16orf70複合体を発見しました。
哺乳類のオートファジー経路に関わる新規因子:BCAS3-C16orf70複合体の発見
研究の背景
私たちの体の細胞は、その中に存在する核やミトコンドリアなどの細胞小器官や、様々なタンパク質が機能することで生命活動を行っています。細胞には、例えば、タンパク質の材料となるアミノ酸が足りなくなった時に、既にある別のタンパク質を分解してアミノ酸をつくり出したり、細胞小器官が故障した時に、それを分解して除去する「オートファジー」というシステムが備わっています。当プロジェクトでは、損傷したミトコンドリアだけを狙ってオートファジー分解する「ミトコンドリアオートファジー(マイトファジー)」の研究を進めてきました。これまで10余年にわたる研究の中で、PINK1(リン酸化酵素)とParkin(ユビキチン連結酵素)が協調して働き、損傷したミトコンドリアにユビキチン(分解の標識となる小さなタンパク質)をつける、という一連の仕組みを明らかにしてきました。
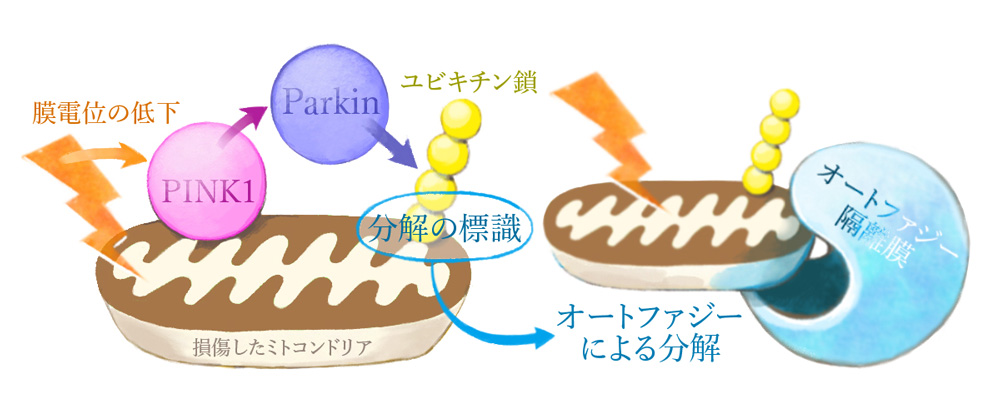
マイトファジーが破綻した場合、分解されずに残った損傷したミトコンドリアは、エネルギー産生などの本来の機能を失っているばかりか、細胞にとって有害な物質を発生させます。その結果引き起こされる細胞死によって、パーキンソン病などの神経変性疾患が発症することが示唆されています。このように、オートファジーは細胞の健康を維持するための重要なシステムであり、そこでどのようなタンパク質が機能するか、どのような場合にシステムが破綻してしまうのかを知ることは、病気の発症を抑えるという医学的応用にもつながっていきます。
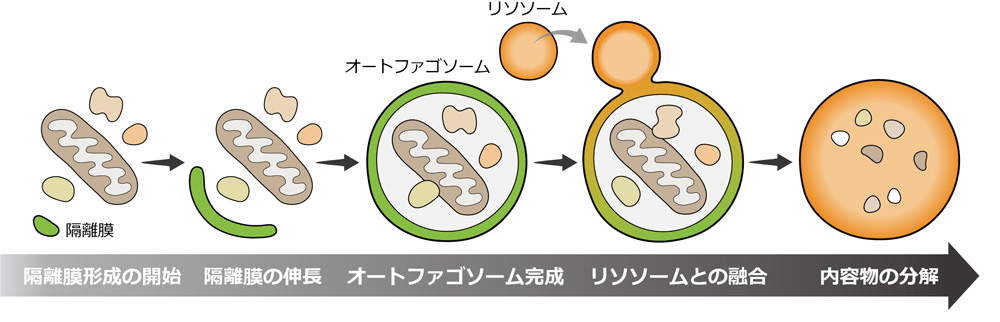
オートファジーでは、隔離膜という脂質二重膜が分解の標的となる物質を取り囲みます。膜は伸長し閉じて(閉じたものをオートファゴソームといいます)、リソソームという細胞小器官と融合し、取り囲まれた内容物はリソソーム内の分解酵素によって分解されます(図1)。2016年にノーベル賞を受賞された大隅先生が、1993年に酵母を用いた研究によって主要なオートファジー因子群を発見されて以来、世界中の研究者が新たなオートファジー関連因子の探索を行ってきました
オートファジーシステムは酵母から哺乳類まで進化的に保存された現象であり、酵母のオートファジーで機能する主要なタンパク質の多くが、ホモログとして哺乳類でも見つかっています。しかし、酵母よりもより複雑な生命活動を行う哺乳類においては、未知のオートファジー関連因子が未だ多く存在するに違いありません。今回、私たちは、哺乳類細胞を用いた研究により、そのような進化の過程で獲得された(酵母にホモログのない)オートファジー関連因子として2つの新たなタンパク質を発見しました。
研究の概要
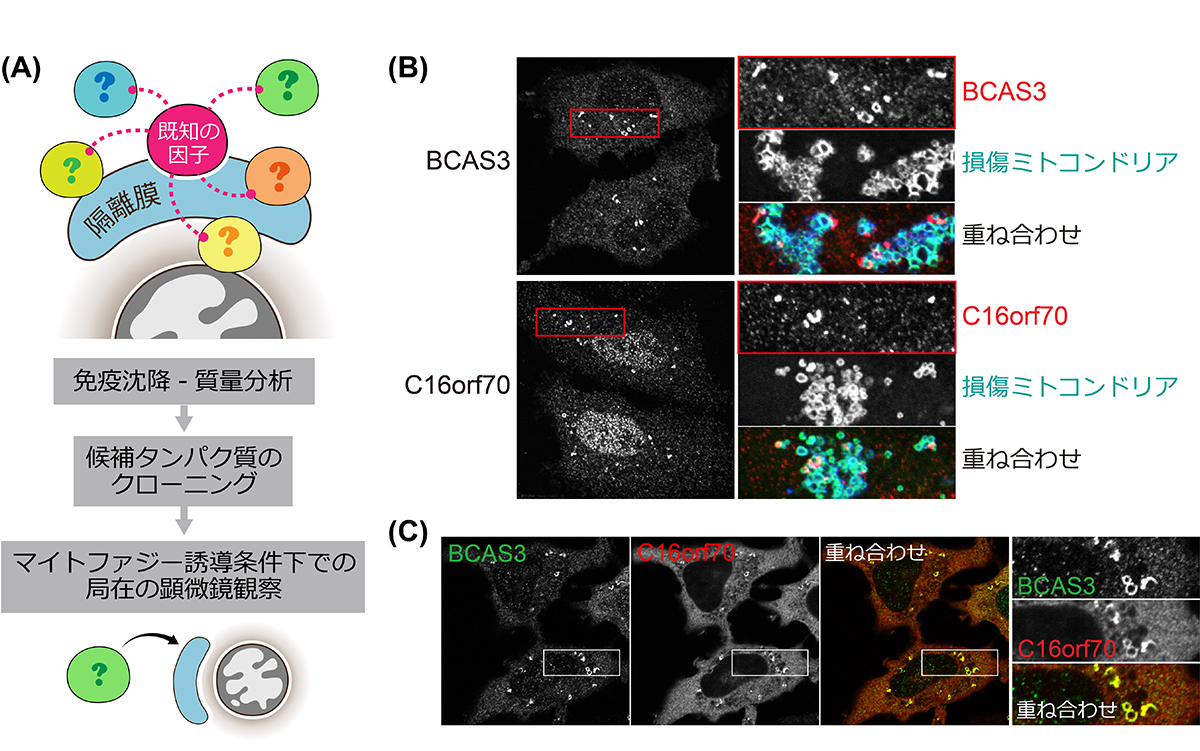
私たちは、マイトファジー誘導条件において、既に知られているオートファジー因子をベイトとした免疫沈降実験-質量分析を行うことにより、効率的なオートファジー関連因子のスクリーニングを実現し、新規オートファジー因子としてBCAS3とC16orf70の2つのタンパク質を同定しました(図2A)。
BCAS3とC16orf70は、通常は細胞質に存在しますが、ミトコンドリアの膜電位を低下させると、その近傍に集まる様子が観察されました(図2B)。また、細胞をアミノ酸飢餓の状態にした時にも、細胞質で集積して輝点として観察されました。これにより、BCAS3とC16orf70は、ミトコンドリア損傷やアミノ酸飢餓によって形成される隔離膜に集積することが示唆されました。また、タンパク質間相互作用を調べる実験や顕微鏡による観察によって、BCAS3とC16orf70が結合して複合体を形成していることがわかり(図2C)、この両因子の結合を阻害してしまうと、オートファジー時の集積も起こらないことがわかりました。
BCAS3とC16orf70は、それぞれ単独で、あるいは両方を欠損させても、オートファジーは問題なく起こることがわかりました。一方で、BCAS3とC16orf70を過剰に発現させた条件では、オートファジーの進行に重要な役割を担ういくつかの因子の集積が阻害されていました。これらのことは、BCAS3-C16orf70が、オートファジーシステムのON/OFFの制御に必須ではない一方で、オートファジーシステムの主要なステップである隔離膜の伸長において、他のオートファジー因子と協調して働くことを示唆しています。
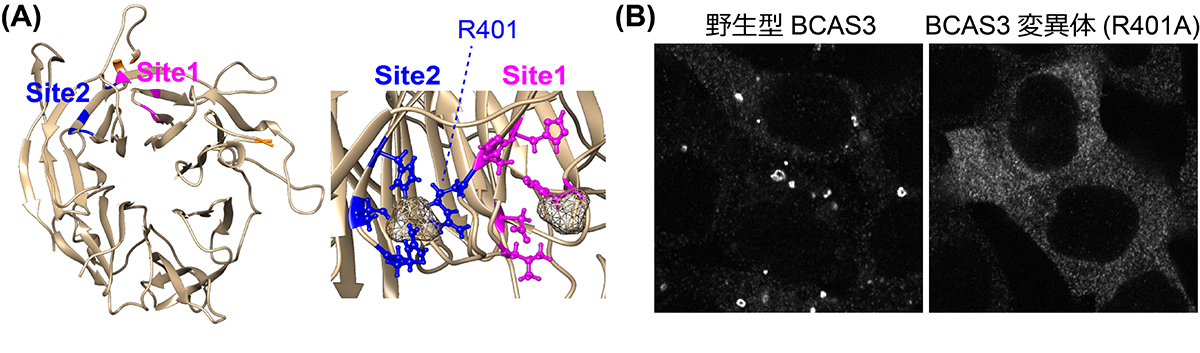
さらに、BCAS3タンパク質の立体構造のモデリングを行い、隔離膜を構成する特定の脂質(PI3P:ホスファチジルイノシトール3リン酸)との結合部位を予測しました(図3A)。試験管内でオートファジー膜を模した脂質膜を作製し、BCAS3タンパク質を混ぜて反応させると、PI3Pが含まれる場合にのみ、BCAS3がその膜に結合することが実験的にも示されました。また、BCAS3の脂質結合部位を構成するアミノ酸を別のアミノ酸に変えたり、領域を欠損させると、隔離膜への集積が阻害されたため(図3B)、実際にBCAS3が予想された結合部位を介して隔離膜上の脂質と結合していることが強く示唆されました。
研究の意義と今後の展望
今回、哺乳類細胞を用いてオートファジー関連因子のスクリーニングを実現し、これまでオートファジーに関わることが知られていなかった2つのタンパク質のBCAS3とC16orf70を新規のオートファジー因子として同定しました。また、タンパク質間の相互作用を調べる実験や、顕微鏡による観察によって、BCAS3とC16orf70が複合体を形成し、隔離膜上に集積することを示しました。さらに、BCAS3タンパク質の立体構造のモデリングを行い、変異体を用いた解析を組み合わせることで、隔離膜を構成する特定の脂質との結合部位を明らかにしました。
オートファジーでは様々な因子が重複した機能を持ってシステムを進行させるため、今回のように、特定の因子を欠損させてもその進行には影響が出ないことがしばしばあります。このような「非必須な関連因子」は、哺乳類のような複雑な生命活動を行う生物が直面しうる多様な状況に対応するための「柔軟性」をもたらす役割があるのではないかと考えています。システムの進行に必須ではない故に解析が難しい面がありますが、既に知られている非必須なオートファジー関連因子の中には、ヒトの疾患の原因因子として報告のあるものもあり、今回発見されたBCAS3-C16orf70複合体についてもさらなる機能解析が求められます。また、オートファジーは細胞の健康を維持するための重要なシステムであることから、今回の研究のように、そこでどのようなタンパク質が機能しているかを明らかにすることは、どのような場合にシステムが破綻してしまうかを知り、病気の発症を事前に抑えるという医学的応用にもつながると期待されます。

2020年7月2日
ユビキチンプロジェクトの山野晃史主席研究員、松田憲之プロジェクトリーダーらは「ユビキチンで標識された損傷ミトコンドリアをオートファジー分解に導く分子機構の発見」について発表しました。
ユビキチンで標識された損傷したミトコンドリアは
OPTN(Optineurin) - ATG9Aの相互作用を介してオートファジーで分解される
研究の背景
当プロジェクトでは、損傷したミトコンドリアの選択的なオートファジー分解(マイトファジー*1))の研究を進めています。我々は10余年にわたり、PINK1(セリン・スレオニンキナーゼ*2))とParkin(ユビキチン連結酵素:E3*2))が連動して損傷したミトコンドリアの外膜にあるタンパク質をユビキチン*3)化することで、マイトファジーを誘導することを明らかにしてきました(図1)。損傷したミトコンドリアに特異的なマイトファジーの破綻は、ミトコンドリアの品質低下や活性酸素種(ROS)*4)の過剰産生に直結するものであり、遺伝性潜性パーキンソン病*5)の発症のみならず孤発性パーキンソン病の発症にも関与することが示唆されています。
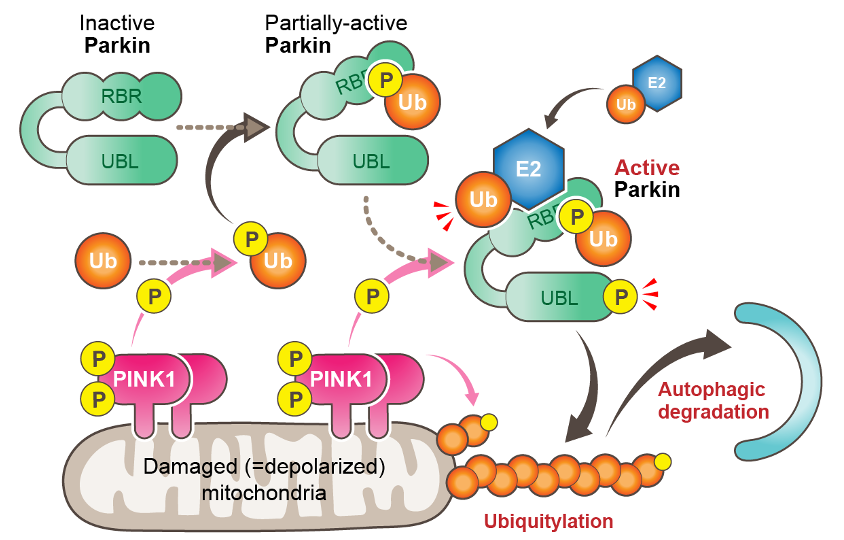
細胞内でユビキチンは選択的オートファジーのシグナルとして機能しますが、その時には一連のアダプタータンパク質がユビキチン鎖と結合し、さらにオートファゴソーム*6)形成に関わる因子と相互作用することで、選択的オートファジーが誘導されると考えられています。
哺乳類の細胞では、ユビキチンと結合する5種類のオートファジーアダプター(p62, NBR1, TAX1BP1, NDP52, OPTN)が知られていますが、PINK1/Parkinの関与するマイトファジーにおいては、OPTNとNDP52が主に機能していると考えられていました。しかしながら、OPTNとNDP52がマイトファジーを誘導する分子メカニズムには未解明な点が残されていました。また、損傷したミトコンドリア上に蓄積するPINK1自身や、PINK1が産生するリン酸化ユビキチンが、オートファジーシグナルとして直接機能する可能性も考えられていました。今回の研究から、PINK1/Parkinによって付加されたユビキチン鎖こそがオートファジーシグナルであることが明確に示されるとともに、ユビキチン鎖がオートファジーシグナルとして読み出される新たな仕組みが明らかになりました。
研究の概要
我々はまず、直鎖状ユビキチン鎖を人為的にミトコンドリアの外膜上に局在させること、またはSNIPER*7)と呼ばれる化合物で、特定のミトコンドリアの外膜にあるタンパク質にユビキチン鎖を付加させることで、マイトファジーが誘導できることを見出しました。これらの結果は、ミトコンドリアの表面でユビキチン鎖が形成されることが、マイトファジーの必要条件であることを示しており、PINK1それ自身やPINK1が産生するリン酸化ユビキチンは、Parkinの活性化に必須であるものの、オートファジーシグナルとして直接機能するものではないことを示唆しています。
次にマイトファジーの誘導時におけるオートファジーアダプター群(p62, NBR1, NDP52, OPTN)の細胞内での局在箇所を調べたところ、全てが損傷ミトコンドリアに局在化していました。しかし、p62とNBR1がミトコンドリア全体に亘って局在するのに対して、NDP52とOPTNはミトコンドリアの一部(サブドメイン)のみに局在することを見出しました。オートファゴソームのマーカー分子であるLC3Bもこのサブドメインに局在したことから、NDP52とOPTNは、ユビキチン化されたミトコンドリアとオートファゴソームの結合部位(コンタクトサイト)に特異的に蓄積していると予想されました。
次に我々は、ユビキチン鎖を認識したNDP52やOPTNと結合して、ユビキチン鎖をオートファジーシグナルに変換する分子の実態に迫りたいと考えました。最も単純な解析方法はアダプター分子の相互作用因子を単離することですが、定法の「免疫沈降産物のMS解析」などは既に研究が行われているので、実験手法に工夫を凝らす必要があります。そこで我々は、タンパク質間の相互作用を蛍光輝点に変換して高感度に検出できる Fluoppiシステム*8)を用いて、この課題に挑みました。このシステムにおいては、ホモオリゴマー形成能を有するAshタグを融合したタンパク質(A)と、四量体形成能を有する蛍光タンパク質であるアザミグリーン(AG)を融合させたタンパク質(B)を細胞に共発現させます。AとBが結合する場合、AとBの相互作用・Ashタグの多量体形成・AGの四量体形成が連鎖的に引き起こされて、細胞内に液-液相分離*9)による液滴が形成されます(図2)。Ashタグをユビキチン鎖に融合させたタンパク質と、アザミグリーン(AG)をオートファジーアダプターに融合させたタンパク質を細胞内で共発現させたところ、液-液相分離による液滴が形成されました(図2)。
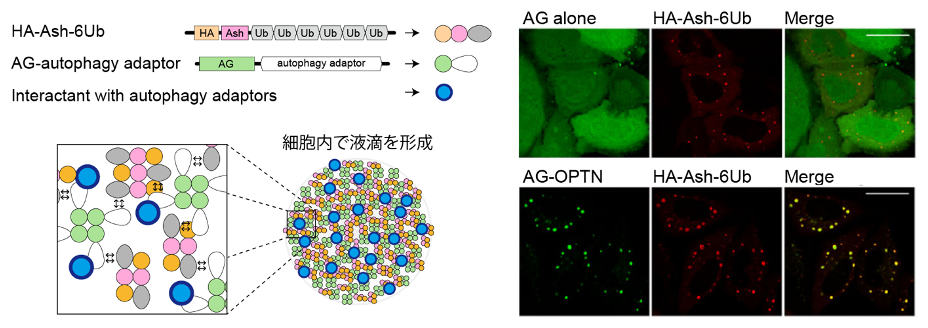
上述のようにNDP52とOPTNは、オートファゴソームのマーカー分子であるLC3Bとミトコンドリアのコンタクトサイトに局在することから、まずオートファジーアダプターとユビキチンが形成する液滴中に、LC3ファミリータンパク質が含まれるかどうかを検討しました。すると、意外にもNDP52やOPTNが形成する液滴よりも、むしろp62やNBR1が形成する液滴の方がLC3ファミリータンパク質を含んでいる(より共局在している)ことが示されました。LC3とp62が相互作用することは既に報告されていますが、上述のようにp62やNBR1は、PINK1/Parkinが誘導するマイトファジーには必須ではないので、LC3との結合能だけでは、マイトファジーにおけるNDP52やOPTNの必要性は説明できないことが示唆されました。
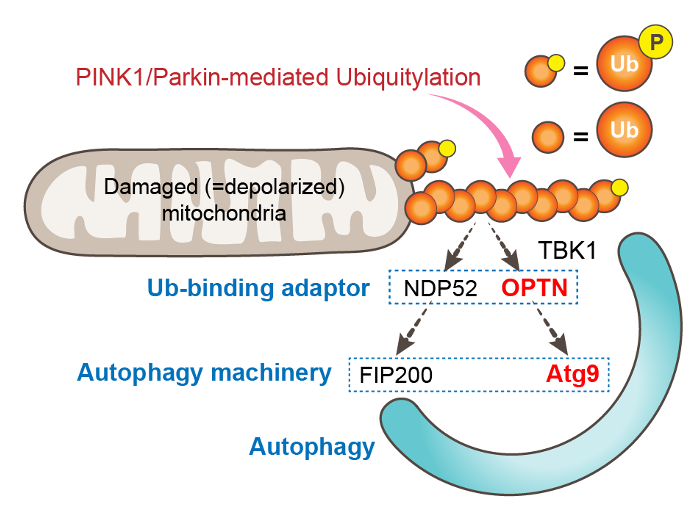
そこで、OPTNと結合してユビキチンシグナルをオートファジーシグナルに変換する分子の実態に迫るべく、OPTNとユビキチン鎖によって形成される液滴中に含まれるオートファジー関連因子(ATGタンパク質)を検索しました。まず ATG13, ATG14, WIPI2, ATG16L1 の局在を調べたところ、いずれもOPTNとユビキチン鎖の形成する液滴中には含まれずに、OPTN の形成する液滴の近傍に小さな点状に局在しました。この局在パターンは、液滴をオートファジー分解の対象とみなして、オートファゴソーム膜で包み込もうとしている状態を反映している可能性が高いと思われます。一方でATG9A(オートファゴソーム形成時に膜を供給する重要因子)について調べると、その局在が、OPTNが形成する液滴に完全に一致することが示されました。他のオートファジーアダプター(NDP52, p62, NBR1)の形成する液滴中にATG9Aは含まれていなかったため、OPTN - ATG9A間に特異的な相互作用があることが示されました。
最後に、OPTN - ATG9A間の相互作用が、PINK1/Parkinの誘導するマイトファジーに必須であるのかどうかを検討しました。OPTNの部分欠失変異体やアミノ酸置換変異体を用いてATG9Aとの結合に必須な部位を絞り込む実験から、OPTNのロイシンジッパードメインがATG9Aとの結合に必須であることがわかりました。実際に、ロイシンジッパードメインに変異を導入したOPTNは、野生型OPTNと同様にユビキチン鎖と液滴を形成しますが、ATG9Aの液滴への局在能は完全に失われました。次に、ロイシンジッパードメインを介したOPTN - ATG9A間の相互作用が、マイトファジーに必須かどうかを検討しました。全てのオートファジーアダプターを破壊した細胞(penta KO 細胞)に、野生型OPTNまたはロイシンジッパードメインに変異を有するOPTNを入れ戻して、マイトファジー活性を測定しました。ミトコンドリアを傷害する薬で細胞を3時間処理した際のマイトファジー活性を定量測定したところ、ロイシンジッパードメインに変異を持つOPTNを入れ戻した細胞は、野生型OPTNを入れ戻した細胞に比較してマイトファジーの活性が25%程度まで減少していました。この結果から、OPTN - ATG9A間の相互作用がPINK1/Parkinの誘導するマイトファジーに非常に重要であることが示されました。
研究の意義と今後の展望
今回の研究は、OPTNがATG9Aと結合することを解明し、既に知られていた ユビキチン→ NDP52→ FIP200 という経路に加えて、ユビキチン→ OPTN→ ATG9Aという経路を介して、PINK1/Parkinがマイトファジーを誘導することを見出したものです(図3)。これまでオートファジーアダプターは、ユビキチンとLC3の両方に結合するタンパク質と定義されていましたが、今回の研究は、オートファジーアダプター分子とオートファジー関連因子との新たな繋がりを示しました。今後はFluoppiシステムを用いたこの研究をOPTN以外のオートファジーアダプターにも応用し、新たな相互作用因子を同定することで、選択的オートファジーの分子基盤の理解をさらに深めていきたいと考えています。
用語説明
- *1)マイトファジー
- ミトコンドリアを特異的・選択的に分解対象とするオートファジーのこと。選択的オートファジーの一種であり、機能不全を起こした不良ミトコンドリアや剰余ミトコンドリアを分解することで、細胞内のミトコンドリア機能を維持していると考えられている。
- *2)PINK1(セリン・スレオニンキナーゼ)、Parkin(ユビキチン連結酵素:E3)
- ともに若年で発症する遺伝性潜性パーキンソン病の原因遺伝子産物である。通常時は、PINK1は分解されて細胞内に存在せず、Parkinは細胞質に存在するが不活性型に保たれている。一方で、ミトコンドリアの膜電位が低下すると、両者はミトコンドリアに存在するようになり、その酵素機能を発揮する。それぞれの変異に由来する患者の病態がよく似ていることなどから、ParkinとPINK1に関連があると予想されていたが、近年では分子レベルで両者の機能が密接に関係していることが示されている。
- *3)ユビキチン
- 酵母からヒトまでが持つタンパク質であり、細胞内で標的となるタンパク質に共有結合(ユビキチン化)することで、標的となるタンパク質の量や細胞内局在等を制御する翻訳後修飾因子である。
- *4)活性酸素種(ROS)
- 酸素分子が反応性の高い化合物に変化したものの総称であり、DNA・脂質・タンパク質と反応して細胞に損傷を与える。そのために、生体内には活性酸素種を消去・除去するさまざまな酵素が存在しているが、分解し切れなかった活性酸素種は、がん・生活習慣病・老化等の様々な疾患の原因になるといわれる。
- *5)パーキンソン病
- アルツハイマー病と並んで頻度の高い進行性の神経変性疾患で、日本では難病に指定されている。中年以降の発症が多く、特に65歳以上の割合が高い。ドパミンの補充を基本とする薬物療法が大きな効果を上げているが、パーキンソン病の原因を取り除いているわけではなく、根本的な治療法・対処法の開発が待たれる。
- *6)オートファゴソーム
- オートファジーで分解される対象物を二重膜に囲み込んだ球状の構造体。最終的にリソソームと結合して内容物を分解(オートファジー)に導く。主な機能として、細胞内の不要物・有害物を掃除することや、細胞が飢餓状態に陥ったときに、細胞質やオルガネラの一部を分解することで生存に必要なエネルギーやアミノ酸を回収することがある。
- *7)SNIPER
- ユビキチン・プロテアソーム系を利用した、生体内の特定のタンパク質を分解するプロテインノックダウン法のひとつで、創薬技術として注目されている。プロテインノックダウン法の原理として、標的としたいタンパク質に、(本来は別なタンパク質を基質とする)ユビキチンリガーゼ(E3)を人工的に引き寄せる手法がある。これにより、標的タンパク質のユビキチン化とプロテアソームによる分解を促進することができる。
- *8)Fluoppiシステム
- 生きた細胞内のタンパク質間相互作用(Protein-protein interaction: PPI)を測定する技術であり、PPIを生細胞内の蛍光輝点に変換して、蛍光顕微鏡での検出を可能にする技術。松田らの研究グループは早くからFluoppiシステムに着目し、世界で最初にFluoppiシステムを用いた成果を論文に報告している(Koyano Nature 2014, Yamano JBC 2015)。
- *9)液-液相分離
- 元々は2つの液体が混ざり合わずに互いに排除しあうことで2つの相に分離する現象のこと。最近の研究から、細胞内では核酸やタンパク質が液―液相分離を起こして周囲の細胞質とは異なる液相を形成し、水に浮かぶ油滴のように細胞内で液滴を形成することが分かってきて、注目されている。