2025年
- 2025年11⽉10⽇〜11⽇ AMED国際シンポジウム2025「The Early-Life Nexus」(慶應義塾⼤学 三⽥キャンパス)にて、丸⼭リーダーが招待講演を、研修⽣杉⽥、⼭崎がポスター発表を⾏いました。
- 2025年10⽉22⽇ 所内で開催した2025年度研修⽣等発表会で研修⽣の杉⽥、⼭崎が発表を⾏い、杉⽥が最優秀賞を受賞しました。(写真)
- 2025年9月11~13日 名古屋で開催された第68回日本神経化学会大会で研修生の和田・杉田が発表を行い、杉田が優秀発表賞を受賞しました。(写真)
- 2025年7月30~8月1日 高校生を対象とした夏のセミナーを開催し実習をしました。(写真)
- 2025年7月24~27日 第48回日本神経科学大会に丸山リーダーが参加し、畠中研究員、研修生の山崎・篠原がポスター発表をしました。(写真)
- 2025年7月14~16日 英国オックスフォード大学St. John’s Collegeにて行われたThe Anatomical Society Summer Meetingに参加し、丸山リーダーが口頭発表、研修生の阿知波がポスター発表をしました。(写真)
- 2025年6月27~28日 AMED-CREST「健康・医療の往生に向けた早期ライフステージにおける生命現象の解明」領域 丸山班「サブプレート神経活動のダイナミズムによる脳神経回路の発達機構」第4回研究班会議を東京都医学総合研究所の講堂にて行いました。(写真)
- 2025年6月4~8日 Black Sea Neurogenesis 2025(ブルガリア)にて、丸山リーダーが口頭発表をしました。(写真)
- 2025年6月2~3日 英国・オックスフォード大学のSherrington Libraryにて、丸山リーダーが神経科学テーマのゲストスピーカーとして講演を行いました。(写真)
- 2025年5月25~28日 Cortical Development Conference 2025(シチリア)にて丸山リーダーが口頭発表をし、守屋・松村研究員と研修生の杉田がポスター発表を行い、杉田がBest Question賞を受賞しました。(写真)
- 2025年 4月15~16日 東京都医学総合研究所にて第30回国際シンポジウム「Principles of Neocortical Development and Evolution II」を主催し、開催しました。(写真)
- 2025年4月 原・元ゲノム研究センター研究員と隈元研究員、丸山リーダーらは、「The spatial transcriptome of the late-stage embryonic and postnatal mouse brain reveals spatiotemporal molecular markers」についてScientific Reportsに発表しました。
- 2025年4月 野村客員研究員と丸山リーダーは「Genetic and developmental bases for mammalian neocortical evolution」についてDevelopment, Growth & Differentiationに発表しました。
- 2025年 4月 3~5日 Brain Development Symposium Kyoto 2025(京都女子大学主催)にて、Zoltan Molnar教授と丸山リーダーが講演を行いました。(写真)
- 2025年3月 Zoltan Molnar教授が都医学研セミナーで講演を行いました。(写真)
- 3月10日:「Development and Evolution of Thalamocortical Connectivity」
- 3月27日:「Transient Circuits in the Developing Brain」
- 2025年3-4月 Zoltan Molnar教授が解剖学講義を3回シリーズで行いました。(写真)
- 3月13日:「Lectures on neuroanatomy-I: Thomas Willis (1621-1675) The Founder of Neuroanatomy and Clinical Neurology」
- 3月26日:「Lectures on neuroanatomy-II: Insight into the Life and Work of Sir Chales Sherrington(1857-1952)」
- 4月9日:「Lectures on neuroanatomy-III: Evolutionary Developmental Biology of the Mammalian Cerebral Cortex」
- 2025年3月9日〜5月7日まで、英国・オックスフォード大学のZoltan Molnar教授を招聘しました。(写真)
- 2025年1~3月にかけて研修生(野村・お茶の水女子大学大学院、片山・杉田・早稲田大学大学院、宋・都立大学大学院)の修士論文発表がそれぞれの大学院で無事終わり、修士号を取得しました。
- 2025年3月12日 所内研究発表会第3部会で優秀発表者賞を研修生の野村が受賞しました。(写真)
- 2025年2月22日 東京都医学総合研究所の2024年度都医学研第8回都民講座「脳とはどのようにして生まれ、進化してきたのか?―ヒト脳への進化の道のりと病―」にて、丸山リーダーが「脳とは何か、どのようにできるのか?」の講演を行いました。(写真)
- 2025年 1月16~17日 AMED領域班会議(TKPガーデンシティ博多)にて、丸山リーダーが口頭発表(オンライン)を、松村研究員がポスター発表を行いました。
- 2025年 1月28日 第14回日本マーモセット研究会で守屋研究員がポスター発表をしました。
2024年
- 2024年11月27~29日 第47回日本分子生物学会年会にて、丸山リーダーが口頭発表をし、研修生の宋、野村、石塚、土井がポスター発表をしました。
- 2024年9月12日 Evolution and Development of Nervous System(クロアチア)にて、丸山リーダーが口頭発表をしました。
- 2024年7月31日―8月2日 高校生を対象とした夏のセミナーを開催し実習をしました。(写真)
- 2024年7月24日―27日 福岡で開催されたNeuro2024に参加し、丸山リーダーと研修生の杉田が口頭発表し、研究員の守屋と研修生の阿知波と和田がポスター発表しました。
- 2024年7月22日 白百合高等学校の生徒12名が医学研に見学に訪れ、実験などを興味深く見学しました。(写真)
- 2024年6月23日 Duke大学Debra Lynn Silver教授が医学研セミナーを開催した。研究員への技術指導をしてもらいました。(写真)
- 20204年6月18日-22日 京都で開催された第57回日本発生生物学会シンポジウムで丸山リーダーが発表しました。
- 2024年6月14日-15日 AMED-CREST「健康・医療の往生に向けた早期ライプステージにおける生命現象の解明」領域 丸山班「サブプレート神経活動のダイナミズムによる脳神経回路の発達機構」第3回研究班会議を東京都医学総合研究所の講堂にて行いました。(写真)
- 2024年6月13日 元研修生金子と丸山リーダーらは、「発生期大脳皮質で移動ニューロンはADAMTS2プロテアーゼを分泌して神経細胞移動を制御する」について EMBO reports に発表しました。
- 2024年5月29日―31日 名古屋で開催された第66回日本小児神経学会シンポジウムで丸山リーダーが発表しました。
- 2024年5月9日 研修生の片山と丸山リーダーらは、「ニワトリ脳発生過程で視床からの神経入力依存的に感覚入力細胞が分化する」について Journal of Comparative Neurology に発表しました。
- 2024年4月19日 丸山リーダーが令和6年度 科学技術分野の文部科学大臣表彰 科学技術賞(研究部門)を受賞しました。(写真)
- 2024年2〜3月にかけて研修生(阿知波-東京大学大学院、森岡-新潟大学大学院)の修士論文発表がそれぞれの大学で無事終わり修士号を取得しました。(写真)
森岡の送別会をしました。(写真) - 2024年3月16日 日本動物学会関東支部第76回大会で優秀発表賞を研修生の片山が受賞しました。(写真)
- 2024年3月13日 桜蔭高等学校の生徒たちが研究室の見学に訪れました。実験の様子などを観察し、研究に興味を持ってくれました。大学院生との交流も喜んでくれました。(写真)
- 2024年3月11日 所内研究発表会第3部会で優秀発表者賞を研修生の森岡が受賞しました。
- 2024年3月8〜9日 第17回神経発生討論会で研修生の杉田と和田が発表し、Young Investigator Awardを和田が受賞しました。
- 2024年2月21日 第13回日本マーモセット研究会で研究員の守屋がポスター発表をしました。
- 2024年2月17日 生化学若い研究者の会 近畿支部・中四国支部共催の冬のセミナーで研修生の杉田が口頭発表を行い、最優秀発表賞を受賞しました。
- 2024年2月16〜17日 生理研研究会:胎児脳発達研究会2024を丸山リーダーが主催しました。松村研究員が口頭発表、研修生の片山がポスター発表を行いました。(写真)
- 2024年1月10〜12日 AMEDの領域班会議が品川で行われ、丸山リーダーが口頭発表、研究員の畠中、松村がポスター発表を行いました。
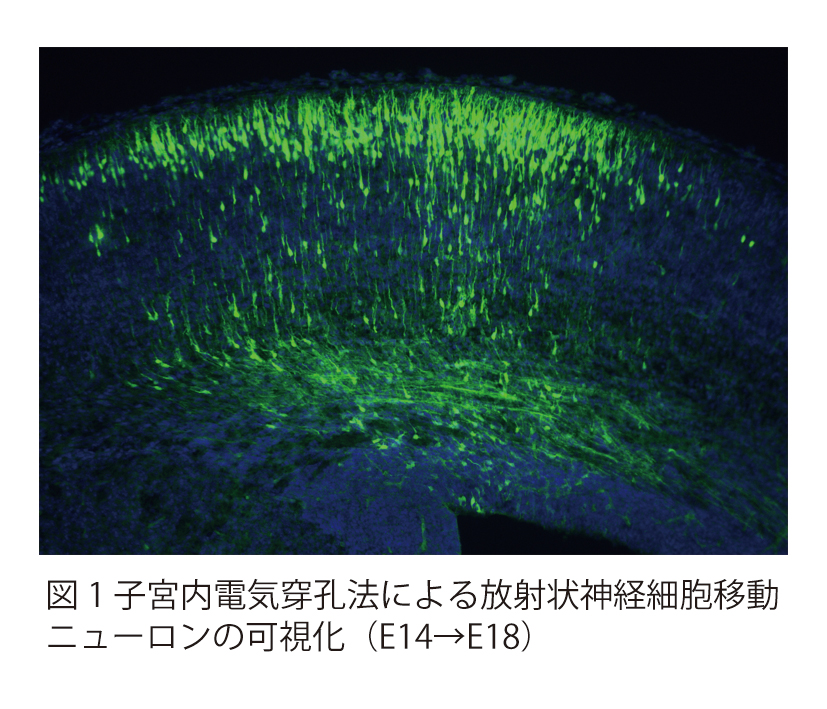
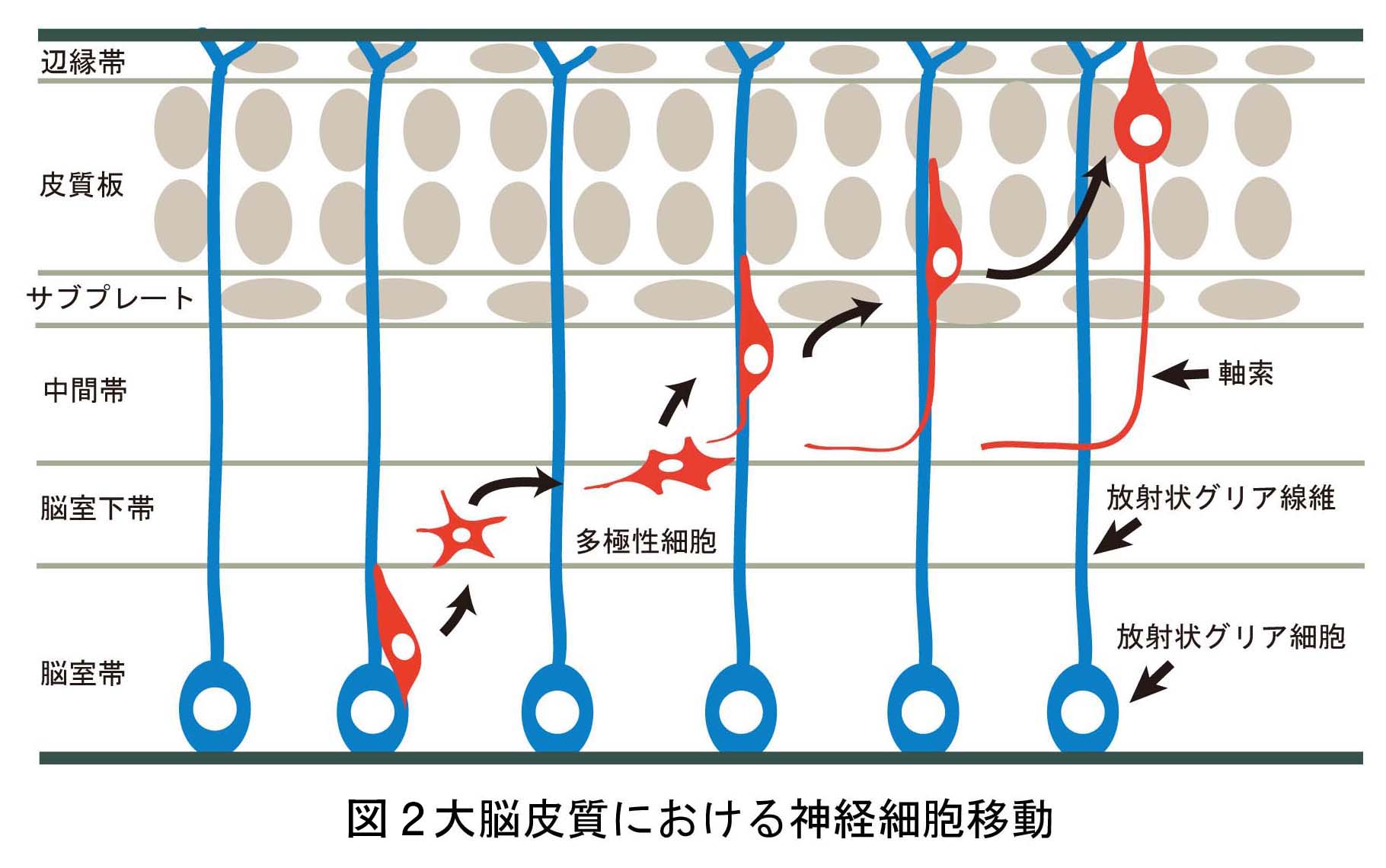
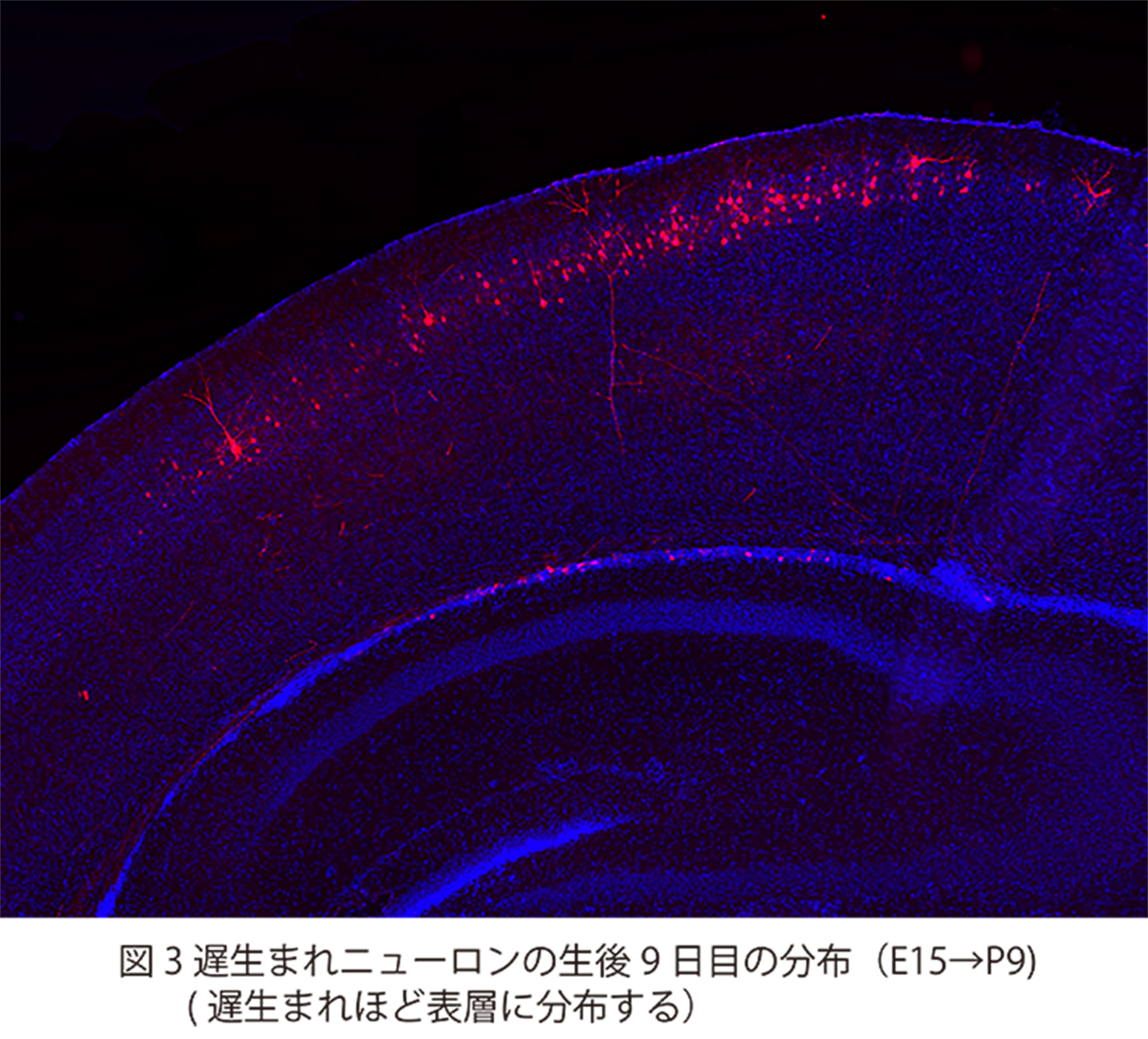
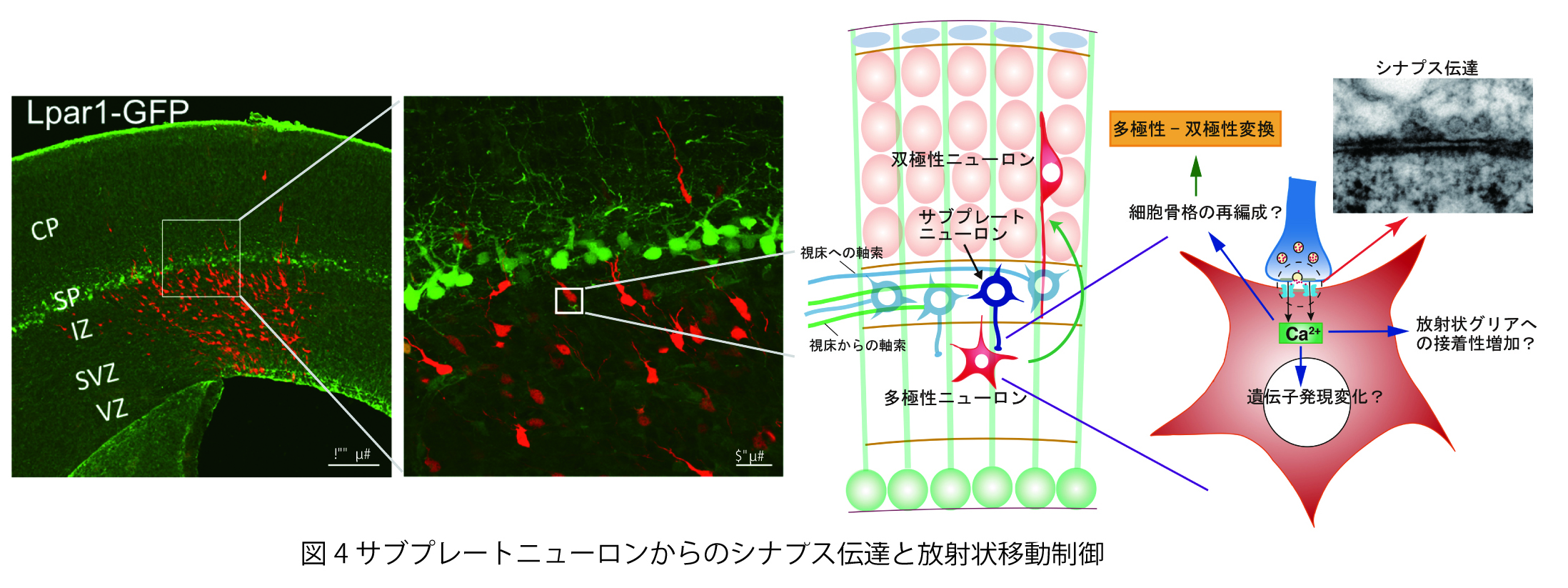
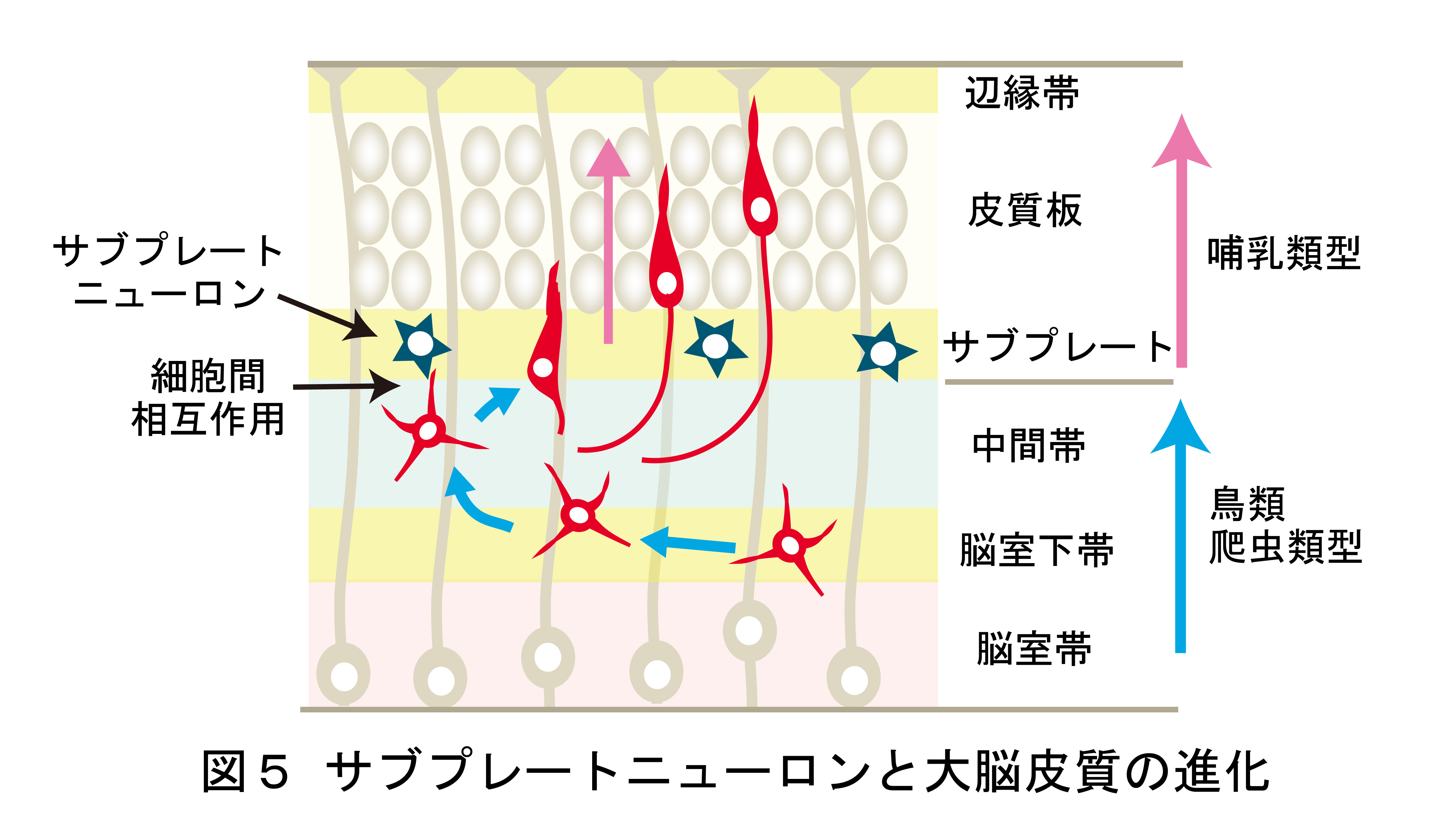
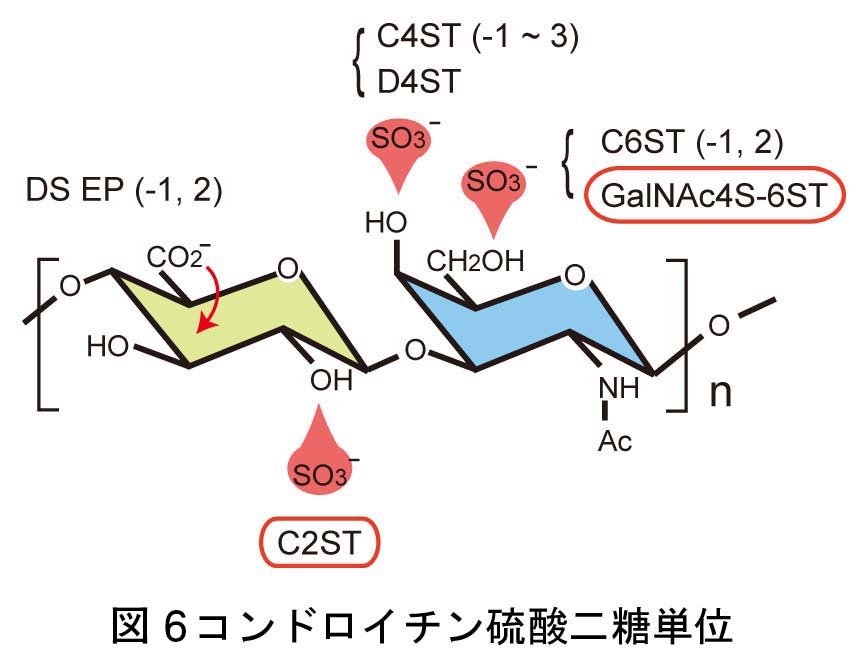
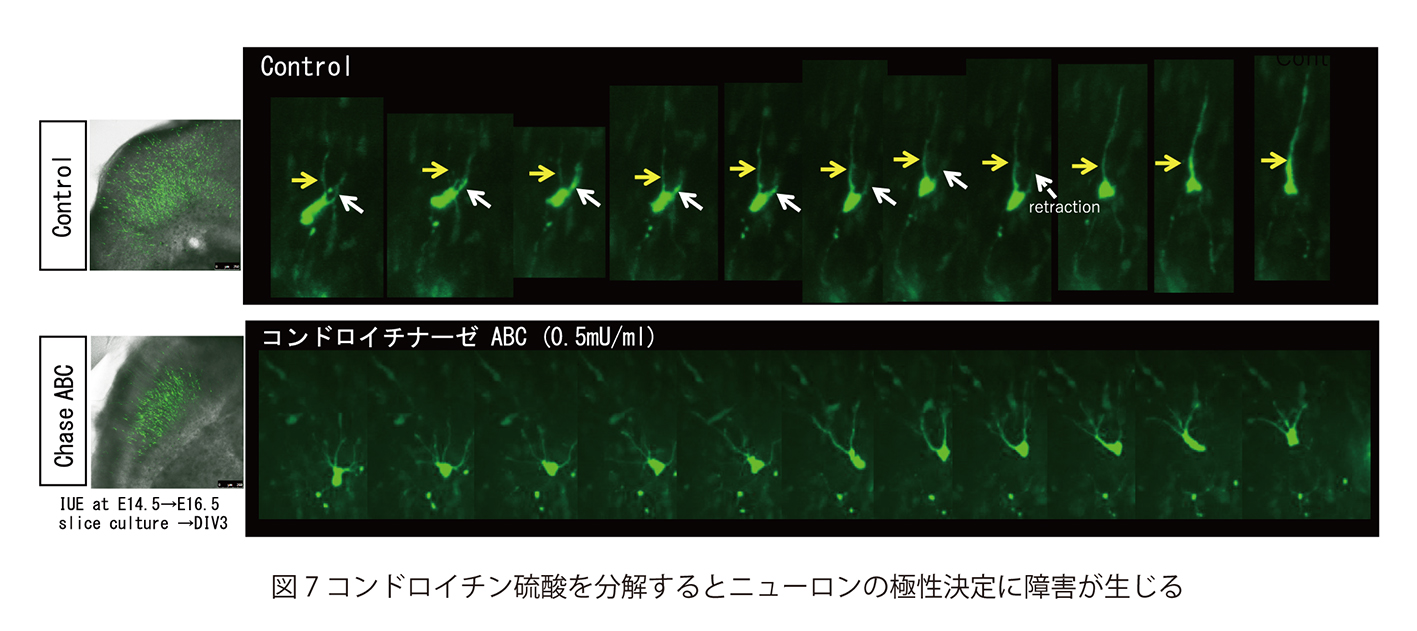
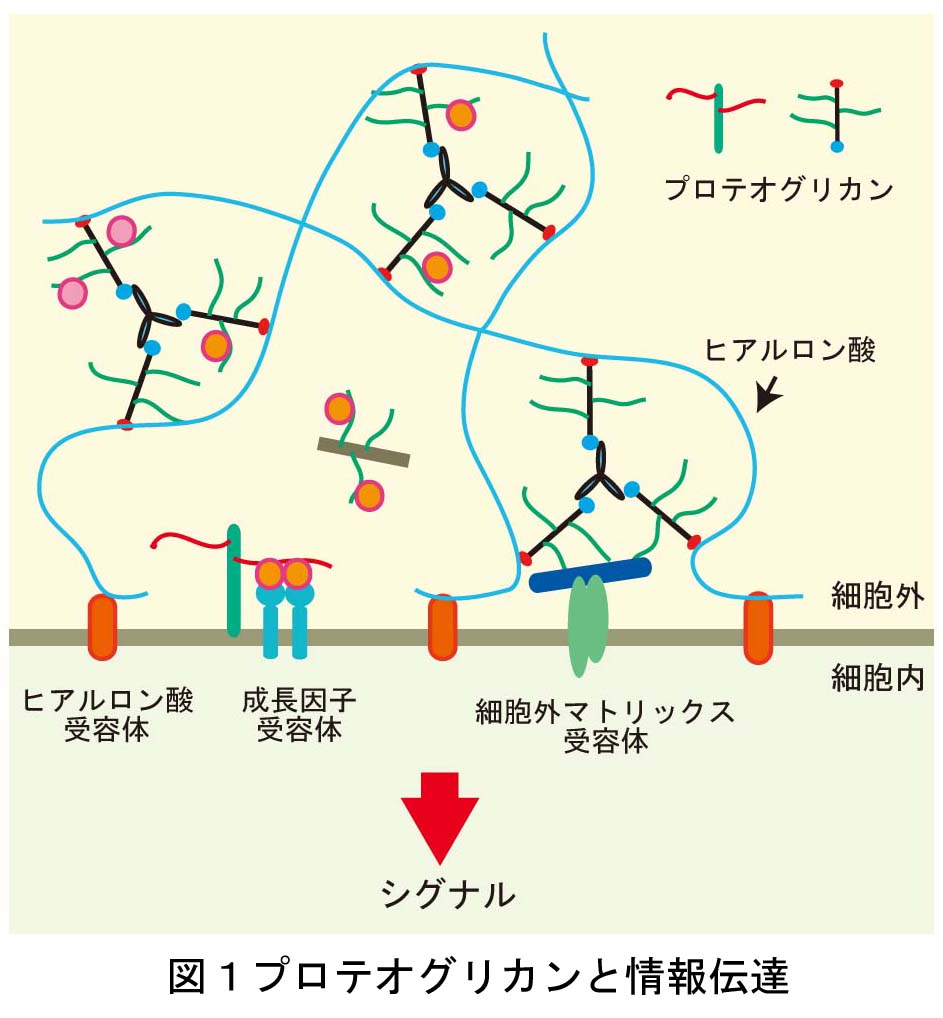
脳神経系を構成する精緻な神経回路は、
どのようなメカニズムで形成されるのか?
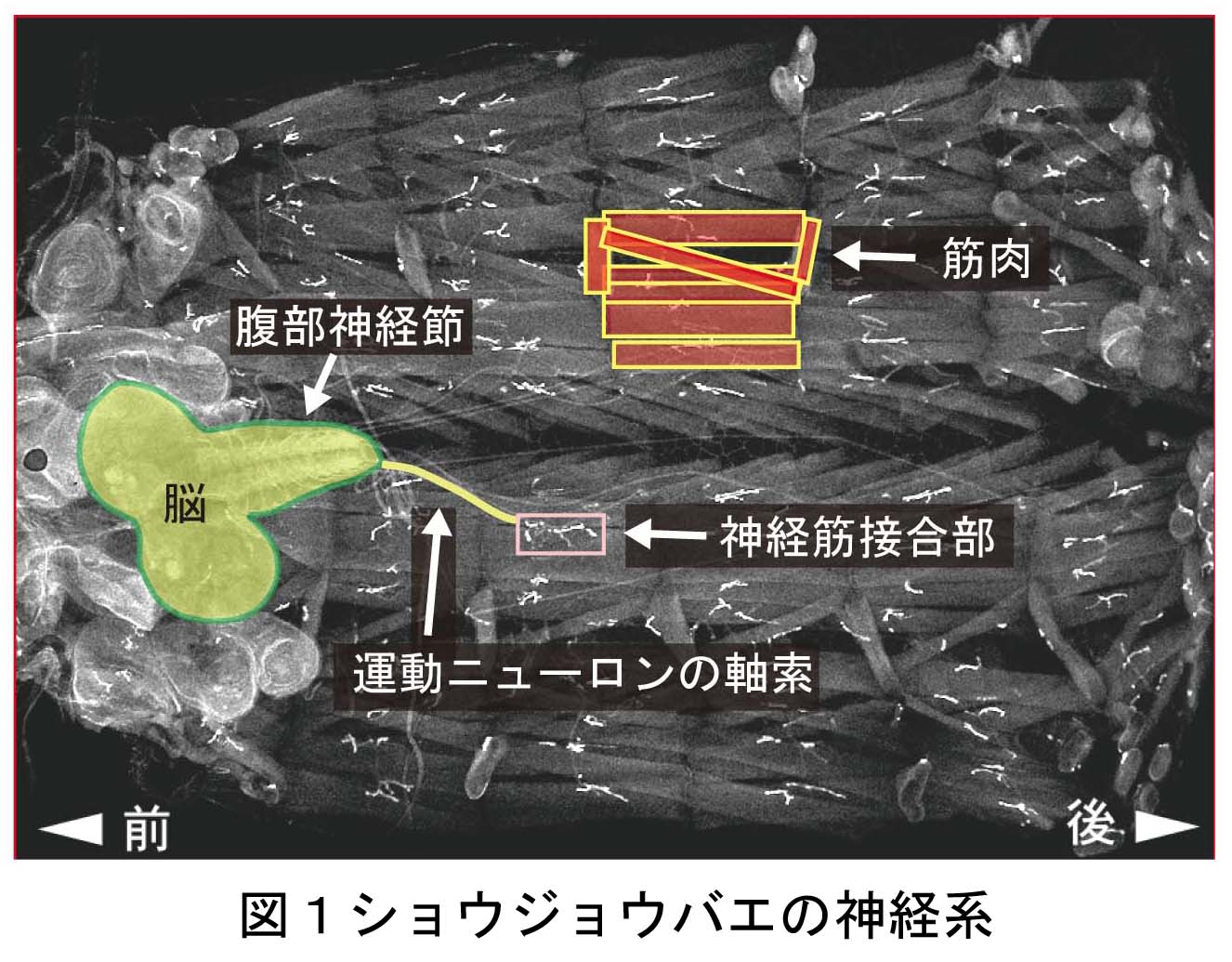
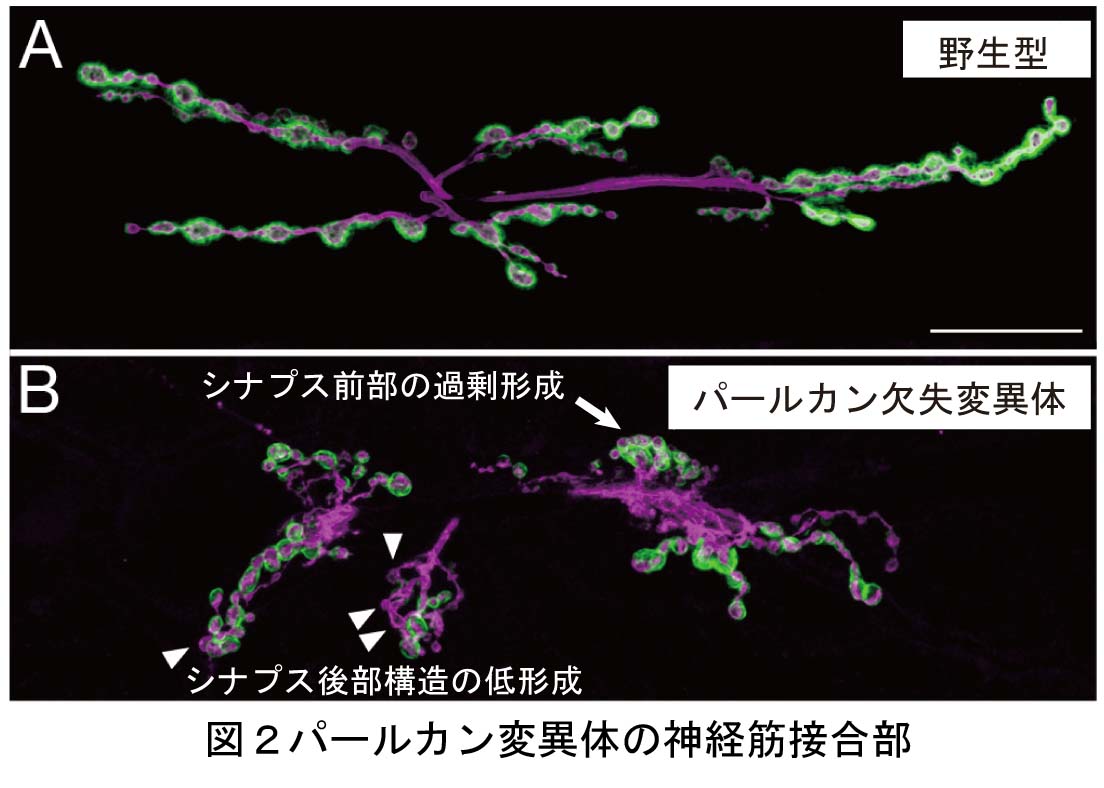
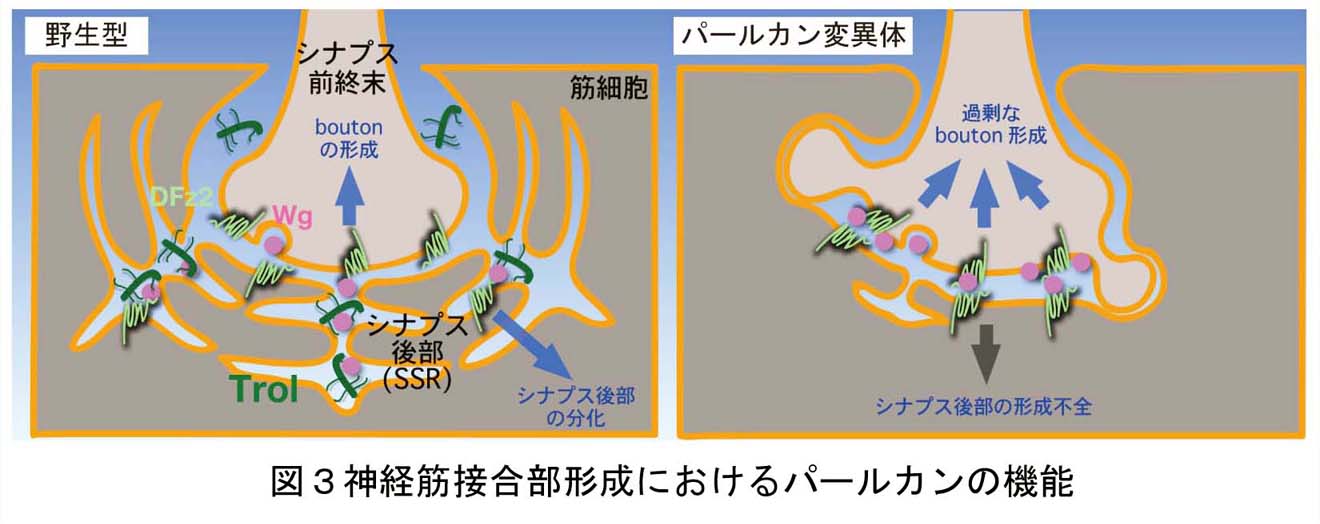
これは、今なお新たな課題が次々に立ち現われてくる深い問題です。神経回路形成は、複雑かつ多様な細胞-細胞間、及び細胞-細胞外マトリックス間の相互作用の下に進行します。本プロジェクトでは、マウス大脳皮質及びショウジョウバエ神経筋接合部をモデルに、このような相互作用の分子メカニズムを解明することを目指しています。