研究紹介
研究の背景
過食、肥満、運動不足、ストレス過多等の生活習慣を背景として、我が国の2型糖尿病患者数は増加の一途をたどり、その予備群を含めると2,000万人以上に達すると推定されている。その多くは無症状に経過するため、慢性合併症が顕在化するまで放置されてしまうケースも少なくない。末梢神経障害は合併症の中で最も早期に出現し、痛みやしびれ等の感覚刺激症状が不眠や抑うつの原因となり、患者が苦痛を自覚しうる疾患として重要である。病期が進行すれば逆に感覚が低下し足のケガや火傷に気付かず、潰瘍や壊疽(えそ)を招いて足切断の原因ともなる。また自律神経障害が進行すると、重症不整脈や無痛性心筋梗塞等の深刻な事態を招く。さらに糖尿病は中枢神経系にも影響を及ぼし、認知症の発症リスクを高めることも明らかとなっている。高齢者の健康寿命延長という観点から、東京都における糖尿病対策は喫緊の課題であり社会的ニーズも極めて高い。しかしながら根本的治療法が確立されていない現状では、食事・運動・薬物療法による「血糖コントロール」に重きを置かざるをえず、その継続には困難を伴う。
当プロジェクトでは、「糖尿病に伴う中枢および末梢神経変性」の機構を解明し有効な治療戦略を打ち立てることにより、糖尿病患者のQOL向上および健康寿命の延伸に貢献することを目指している。
研究内容の紹介
モデル動物(ラット、マウス、ショウジョウバエ)およびニューロン、グリア細胞、血管内皮細胞等の培養系を用いて、糖尿病性末梢神経障害および認知症の発症・増悪機構を詳らかにするとともに、成因に基いた治療法・治療薬の開発を目指している [図1]。
[図1]
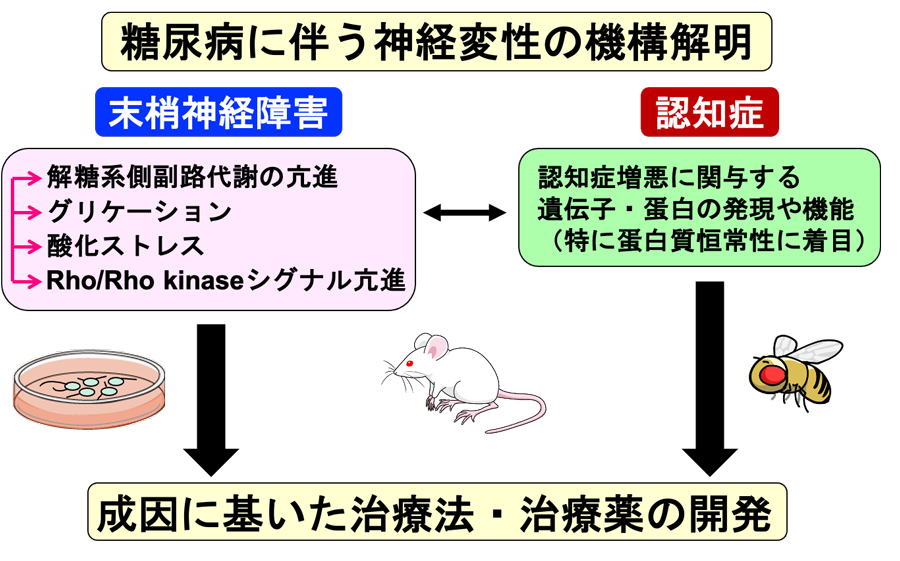
[1] 糖尿病性末梢神経障害の成因解明と治療戦略
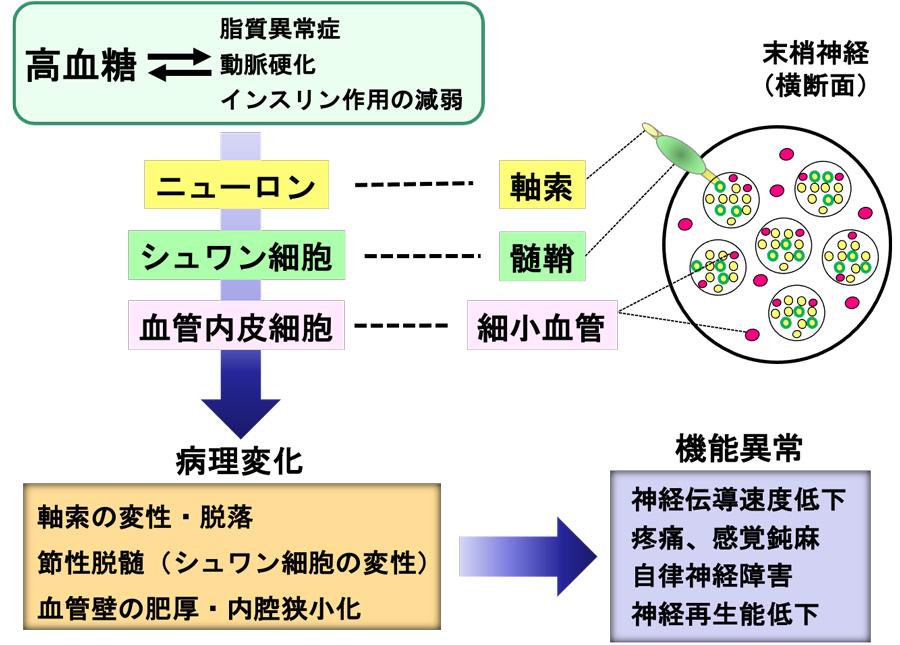
高血糖の持続に伴う組織の代謝異常や細小血管障害が、糖尿病性末梢神経障害の成因と考えられている。また糖尿病に関連した脂質代謝異常、動脈硬化、インスリン作用の減弱なども末梢神経障害の発症に関与する。特にニューロン、シュワン細胞、血管内皮細胞等における代謝異常(解糖系側副路代謝の亢進、グリケーション、酸化ストレス、Rho/Rho kinaseシグナル亢進等)が成因として重要視されており、各成因間に密接なクロストークが存在することも報告されている [図1, 図2]。これらの代謝異常が軸索や髄鞘(ミエリン)の変性・脱落を誘導するとともに、神経を栄養する細小血管を傷害し血流を低下させることにより、末梢神経障害が発症・進行する [図2]。
本研究では、糖尿病モデル動物およびニューロン、シュワン細胞、血管内皮細胞の培養系や共培養系等を用いて、末梢神経障害の発症機構を詳らかにするとともに、成因に基づく有効な治療法の開発を目指す。
[図2]
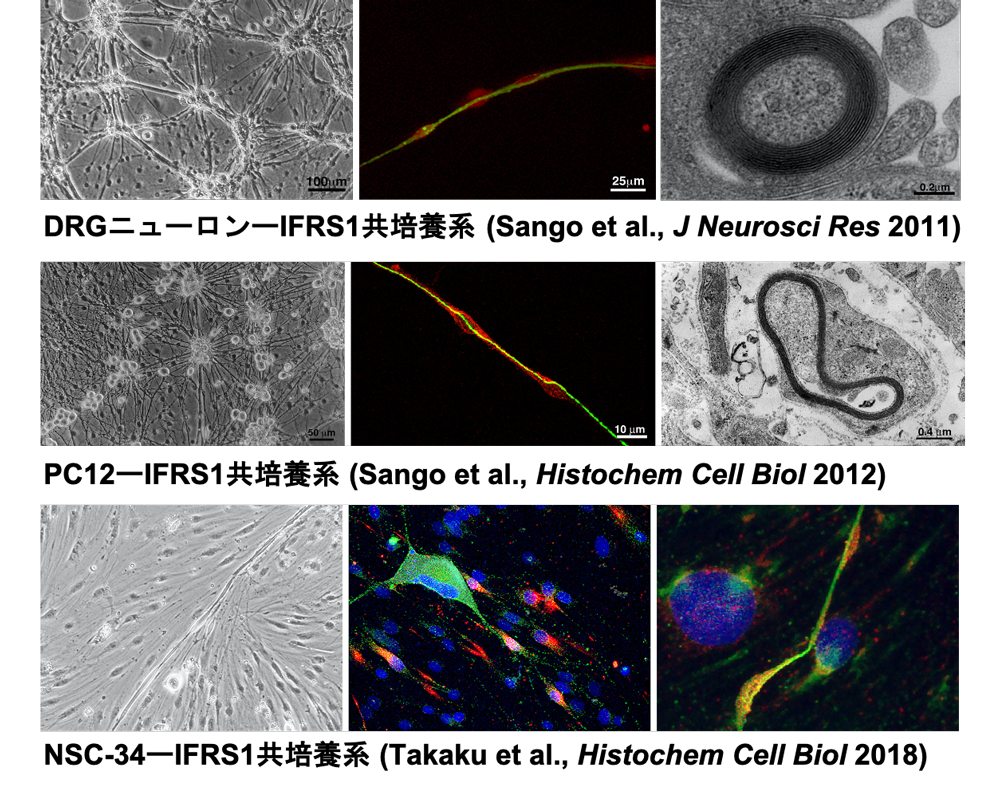
- 初代培養後根神経節 (DRG) ニューロン、株化DRGニューロン (ND7/23)、株化運動ニューロン (NSC-34)、PC12細胞、株化シュワン細胞 (IMS32, IFRS1)
 、株化血管内皮細胞等の培養系 [図3] やそれらの共培養系 [図4]を用いて、高血糖に伴う解糖系側副路代謝、糖化
、株化血管内皮細胞等の培養系 [図3] やそれらの共培養系 [図4]を用いて、高血糖に伴う解糖系側副路代謝、糖化  、酸化ストレス
、酸化ストレス  、Rho/Rho kinaseの亢進機序や各成因間のクロストークを解明する。また解糖系側副路代謝抑制効果を示すピルビン酸やビタミンB1誘導体ベンフォチアミンを糖尿病モデルラットもしくはマウスに投与し、末梢神経障害に対する改善効果を検討する。
、Rho/Rho kinaseの亢進機序や各成因間のクロストークを解明する。また解糖系側副路代謝抑制効果を示すピルビン酸やビタミンB1誘導体ベンフォチアミンを糖尿病モデルラットもしくはマウスに投与し、末梢神経障害に対する改善効果を検討する。 - アルドース還元酵素 (AR) 遺伝子欠損マウス、最終糖化産物受容体 (RAGE) 遺伝子欠損マウス、及び各マウスより樹立したシュワン細胞株IKARS1
 、IRGS1を用いて、ポリオール代謝亢進や糖化を介した神経障害の発症機構を解明する。
、IRGS1を用いて、ポリオール代謝亢進や糖化を介した神経障害の発症機構を解明する。 - Rho/Rho kinaseシグナル亢進に伴う神経障害の発症機構を解明し、Rho kinase阻害薬の神経障害治療薬としての有用性を検証する。
- 血糖降下薬として臨床応用されているglucagon-like peptide (GLP)−1受容体作動薬の神経系に対する直接保護効果
 に注目し、神経障害治療薬としての有用性を検証する。
に注目し、神経障害治療薬としての有用性を検証する。 - 高ショ糖餌負荷による糖尿病モデルショウジョウバエを用いて、末梢神経障害の発症機構を解明する。
[図3]

[図4]
[2] 糖尿病・過栄養食による認知症の促進機構解明と予防・治療法の開発
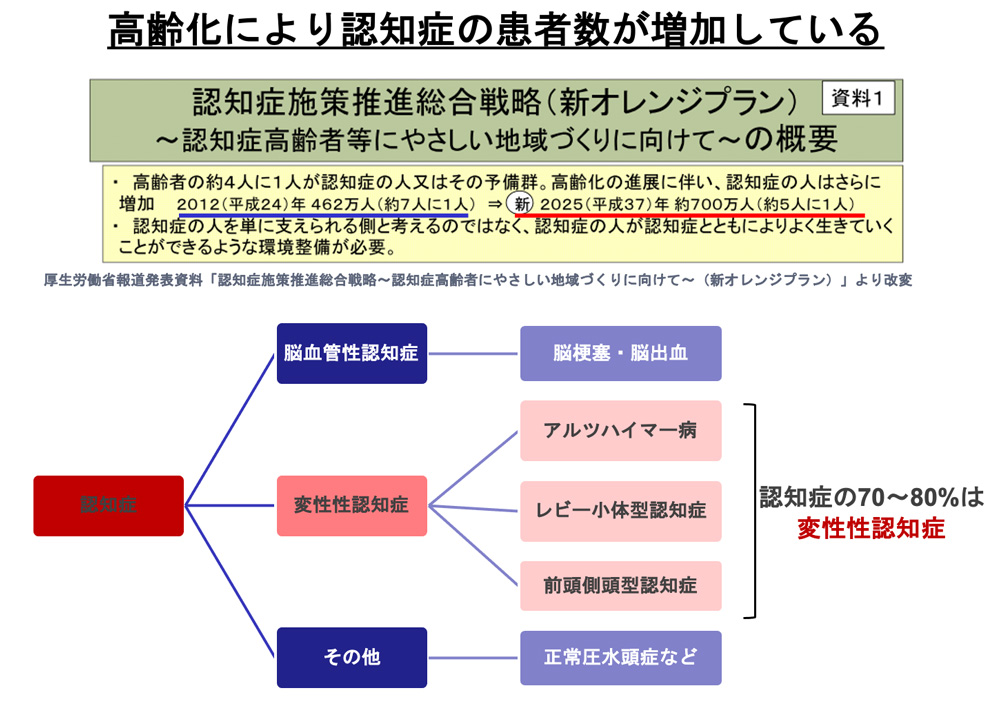
高齢化社会を迎えるわが国において、加齢に伴い発症する認知症の患者数は増加の一途を辿っている。アルツハイマー病、レビー小体型認知症、前頭側頭型認知症などの変性性認知症は認知症の原因の多くを占めているが、これらの疾患に対する根本的治療法は無く、症状が進行することで徐々に患者のQOLが失われ介護にかかる労力も多大であることから、社会的にも大きな問題となっている [図5]。
[図5]
近年、糖尿病が認知症の危険因子であることが疫学調査から支持され、世界的に注目を集めている [図6]。糖尿病患者がアルツハイマー病および脳血管性認知症になる割合は正常者の2~4倍とされ、さらに最近ではこれら二者とは異なる糖尿病性認知症という臨床病型も提唱されている。一方、老化研究では様々な生物種において食事制限が加齢変化を抑制し寿命を延長させることが示され、食餌・栄養代謝と老化が密接に関連すると考えられている。
[図6]
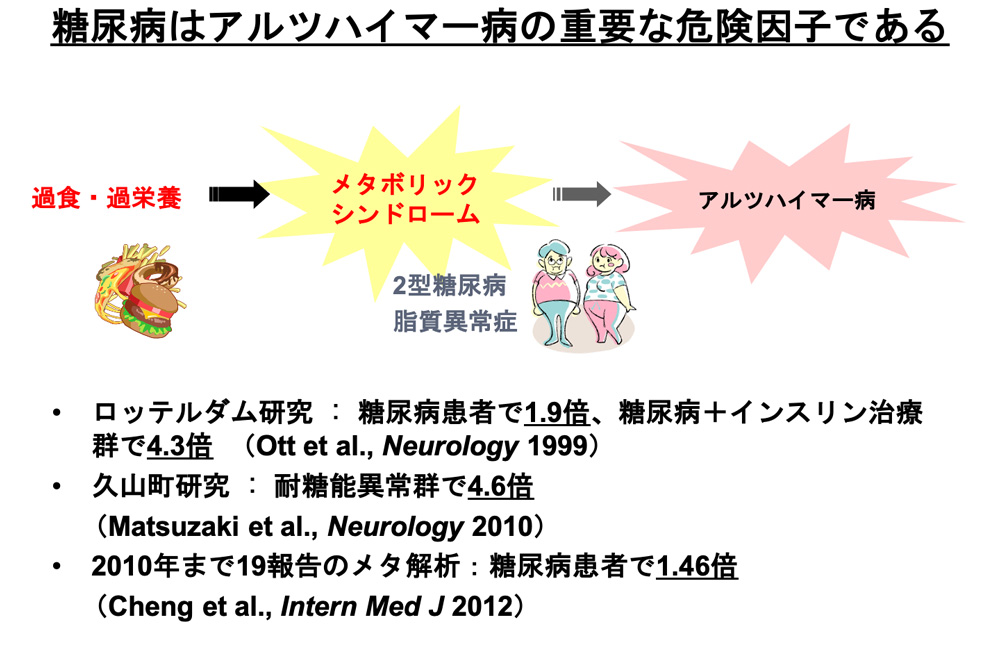
上記の知見から、糖尿病やその原因となる過栄養な食餌が変性性認知症の発症・進行を促進する重要な要因であると考え、遺伝学的解析に優れた小型モデル動物であるショウジョウバエを用いて、個体レベルの解析を中心に以下の研究を行っている。[図7]
[図7]
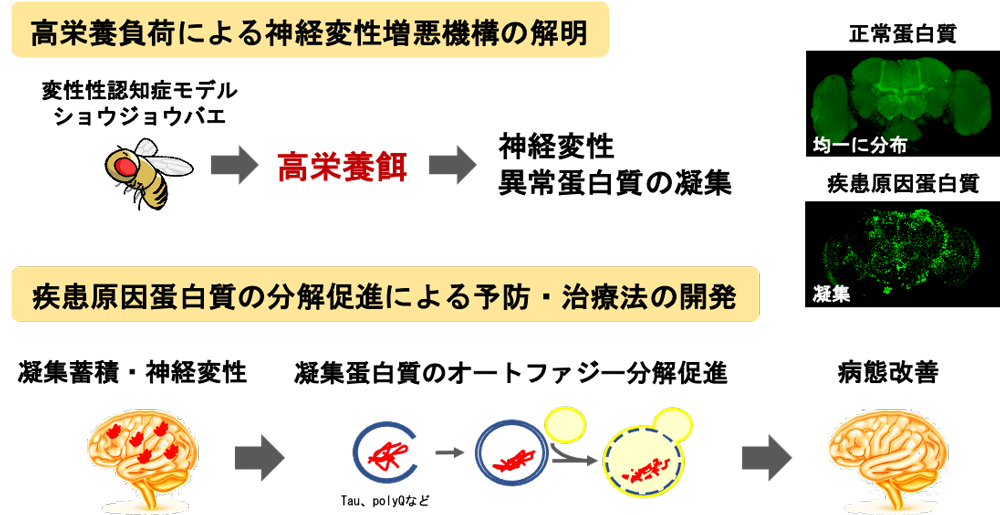
- 変性性認知症の発症・進行に対する糖尿病および過栄養食の影響とその分子メカニズムの解明
- 神経変性疾患原因蛋白質の分解促進による予防・治療法の開発
本研究により新たな治療標的分子を同定し、認知症や発症分子メカニズムが共通する他の神経変性疾患に対する治療法の開発を目指す。
共同研究機関
東京慈恵会医科大学 内科学講座 糖尿病・代謝・内分泌内科
弘前大学大学院医学研究科 分子病態病理学講座
愛知学院大学薬学部医療薬学科 薬物治療学講座
愛知学院大学歯学部 内科学講座
東邦大学医学部(自然・生命・人間先端医学講座)額田医学生物学研究所
東京薬科大学生命科学部 分子神経科学研究室
川崎医科大学 神経内科学教室
前橋工科大学工学部 生物工学科
芝浦工業大学システム理工学部 生命科学科
杏林大学保健学部 理学療法学科
昭和大学薬学部 基礎医療薬学講座 薬理学部門
東京工科大学応用生物学部 細胞酸化ストレス研究室
謝辞
図中イラストの一部を 渡邉真生  様 にご提供頂きました。
様 にご提供頂きました。


