Topics
研究成果
- 視神経の再生に新たな可能性 ~DOCK3とHAUS7の連携が軸索再生を促進~
- DOCK3の構造変化を起こす低分子化合物による神経保護と軸索再生
- 緑内障モデルにおいて病態の進行を予防し、視神経を再生する、新しい遺伝子治療ベクター
- 網膜グリア細胞の機能異常が正常眼圧緑内障を引き起こす仕組み
- グリア細胞に発現するASK1が神経炎症を制御する仕組み
- DOCK-D family蛋白が神経炎症を制御する仕組み
- 日本人に多い「正常眼圧緑内障」を発症する、ヒトに近い緑内障モデルを発見
- DOCK8はミクログリアに発現して、神経変性を悪化させることを発見
- カロリー制限による網膜神経細胞死の抑制に成功
- 抗てんかん薬から緑内障治療薬へ
- グルタミン酸毒性による網膜神経細胞死の抑制に成功
- 薬剤による視神経損傷の軽症化に成功
- 網膜保護・再生の新たなメカニズムを解明
- 新規薬剤による多発性硬化症モデル動物の軽症化に成功
- 視神経の再生メカニズムを解明
- 世界初の正常眼圧緑内障のモデル動物を開発
- 欧州分子生物学機構機関誌「EMBO Molecular Medicine」で研究成果を発表 -
新規薬剤による多発性硬化症モデル動物の軽症化に成功
視覚病態プロジェクトでは、東京大学、メルクセローノ株式会社(スイス)との共同研究により、視神経および脊髄の炎症や脱髄を抑制する新たな薬剤を見出し、マウスでの多発性硬化症の症状を軽症化することに成功しました。
この研究成果は、欧州分子生物学機構機関誌「EMBO Molecular Medicine」オンライン版  で2010年11月10日に発表されました。
で2010年11月10日に発表されました。
研究の背景
多発性硬化症(multiple sclerosis: MS)は中枢神経系の脱髄疾患のひとつで、脳・脊髄・視神経の病変によって視覚障害や運動障害などがおきます。国内の患者数は一万二千人を超えていますが、詳しい原因は解明されておらず治療も困難であることから、厚生労働省が指定する特定疾患のひとつになっています。
MSでは免疫細胞の活性化に続き、アストロサイトと呼ばれるグリア細胞から炎症を悪化させるタンパク質(ケモカイン)が放出され、脱髄が進行すると考えられています。しかし炎症細胞に関する免疫学的研究と比べて、グリア細胞に注目した研究は非常に少ないのが現状です。そこでMSが発症する際のアストロサイトの機能を調べて病態への理解を深めることによって、将来的に新しい治療法を開発できるかもしれません。
研究の概要と成果
視神経や脊髄の神経線維は髄鞘(ミエリン)というカバーに覆われていて、それが絶縁体の働きをしています。MSではこのミエリンが何らかの原因で破壊され(脱髄)、神経伝達がうまくいかなくなることから、視力低下や歩行障害などの症状が出現します(図1)。したがって、ミエリンの破壊をいかにして防ぐかがMS治療のポイントになります。
図1 脱髄とは何か?
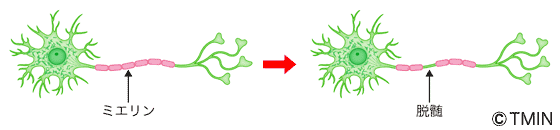
神経細胞から出された情報は電気信号となって神経線維を伝わっていきます。その神経線維を覆っているミエリンが破壊される現象が「脱髄」です。脱髄がおきた部分からは電気信号が漏れていくため、神経細胞からの情報や指令が末端まで伝えられなくなります。これが視神経で起きれば視覚障害を引き起こすことになります。
私達はToll様受容体*1と結合して自然免疫系を制御するapoptosis signal-regulating kinase 1(ASK1)という分子に注目しました。ASK1はアストロサイトに発現していて、炎症性サイトカインの産生を促進することが予想されたからです(図2)。
図2 自然免疫、ASK1と予想される多発性硬化症との関係
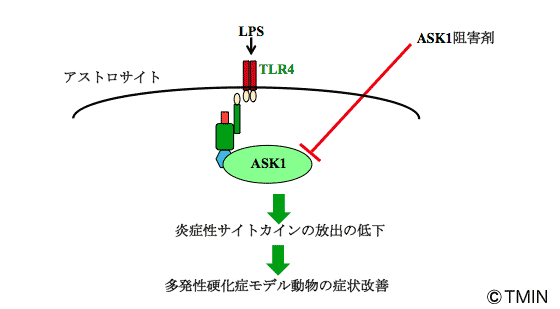
ASK1の阻害によりアストロサイトの自然免疫系が抑制され、炎症性サイトカインの放出が低下すれば、多発性硬化症も改善するかもしれないと予想しました。
そこで実際にASK1欠損マウスを用いてMSのモデル動物(実験的自己免疫性脳脊髄炎)を作製したところ、脱髄が抑制され、視神経炎や脊髄炎が軽症化することを見出しました。そこでASK1の作用を抑制する新規薬物の開発を行い、合成したASK1阻害剤をMSモデル動物に経口投与したところ、ASK1欠損マウスと同様の治療効果が得られることを確認しました(図3)。
図3 新規薬物の開発と多発性硬化症モデル動物における治療効果
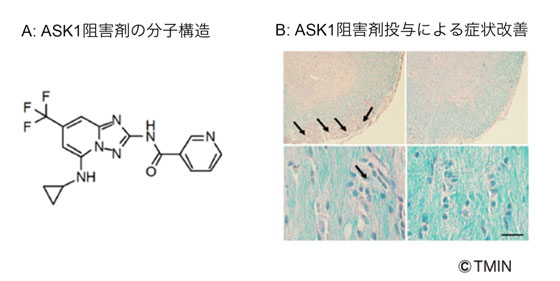
A 開発されたASK1阻害剤の分子構造
B 無治療群では脱髄によるミエリン(水色で染められた部分)の減少(矢印)が見られますが、治療群では抑制されていました。
研究の意義
MSは20-40代の若い世代に多く発症し、患者さんの中には重度の視覚障害が残る方や車いす生活を余儀なくされる方もいます。将来的にASK1阻害剤のような新薬がMSの治療に使用できるようになれば、既存の免疫抑制剤などとの相乗作用により、より良い治療効果が得られる可能性があります。
用語説明
- *1 Toll様受容体(Toll-like receptor; TLR):
- 種々の病原体を感知して自然免疫を作動させ、感染防御を可能とする受容体。これまでは非特異的な生体防御システムと考えられてきたが、最近では自己免疫疾患などとの関わりも注目されつつある。
論文名
Guo X, Harada C, Namekata K, Matsuzawa A, Camps M, Ji H, Swinnen D, Jorand-Lebrun C, Muzerelle M, Vitte P, Ruckle T, Kimura A, Kohyama K, Matsumoto Y, Ichijo H, Harada T.
 Regulation of the severity of neuroinflammation and demyelination by TLR-ASK1-p38 pathway.
Regulation of the severity of neuroinflammation and demyelination by TLR-ASK1-p38 pathway.
EMBO Molecular Medicine 2: 504-515, 2010.
本研究の成果は平成23年1月4日の毎日新聞朝刊で報道された。


