
Ozawa A, Toriumi K, Shimada T, Endo A, Tomita T, Munesue S, Tomita Y, Takagi H, Parida IS, Miyashita M, Inagi R, Itokawa M, Yamamoto Y, Saeki Y, Arai M. Pentosidine modification of neuronal proteins induces dendritic spine enlargement in vitro. Biochem Biophys Res Commun (2025) 793: 153032.
doi: 10.1016/j.bbrc.2025.153032
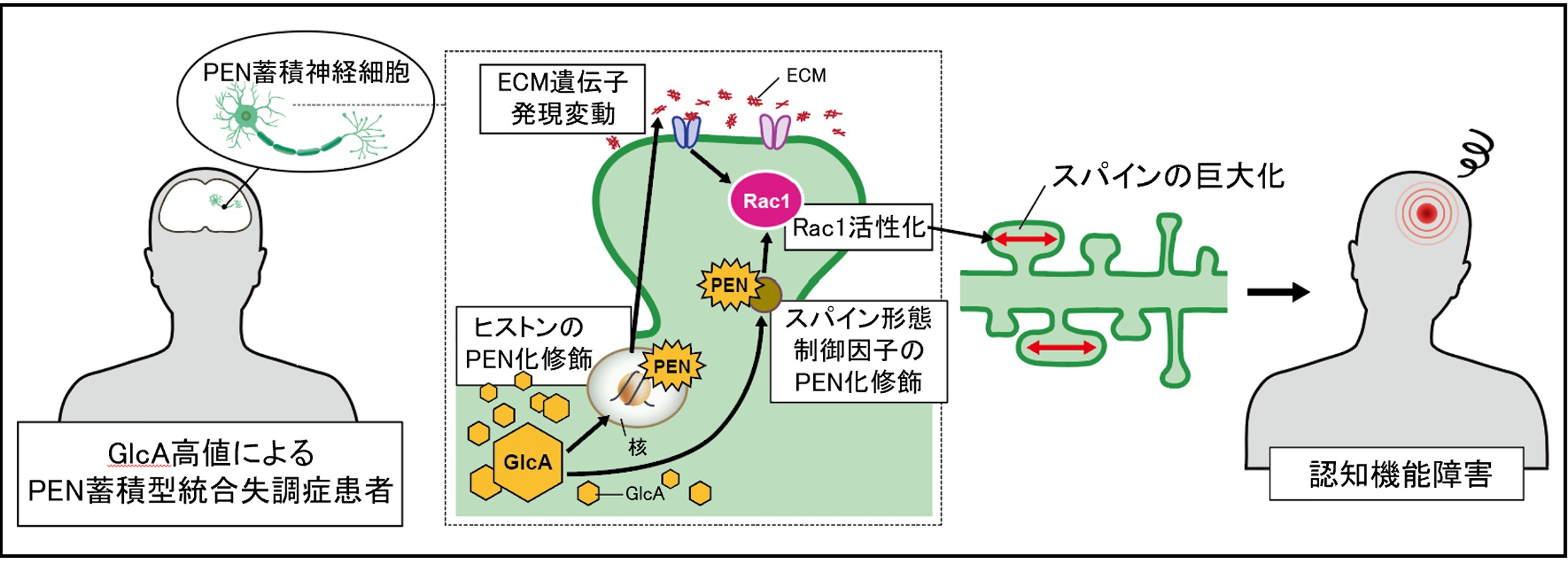
私たちはこれまでに、終末糖化産物(AGE)の一種であるペントシジン(PEN)が、統合失調症患者のおよそ40%の血中で蓄積していることを見出しました[1]。PEN高値の患者さんでは、入院の頻度や期間、抗精神病薬の累積投与量が多く、情報処理速度を中心とする認知機能障害もより強いことが報告されています。また、精神症状が重く、標準的な薬物療法に抵抗性を示しやすい傾向もあります[2]。
AGEによる糖化修飾は、持続的な高血糖や代謝ストレスのもとでメイラード反応により形成され、タンパク質の機能喪失を生じることが知られています[3]。しかしながら、統合失調症病態におけるPENの障害分子機序は、PEN蓄積を再現した細胞モデルが存在しないこともあり、十分に解明されていませんでした。
そこで本研究では、神経細胞内のPEN蓄積を再現するin vitro細胞モデルを構築し、神経細胞内タンパク質のPEN化修飾が神経細胞の構造的な健全性を損ない、統合失調症の病態形成に寄与する可能性を検討することを目的としました。
近年、我々は統合失調症患者で蓄積したPENの前駆物質として、グルクロン酸(GlcA)を同定しました[4]。そこで患者の血中濃度と同程度のGlcAをマウス初代神経細胞に添加し、PEN量を高速液体クロマトグラフィー(HPLC)で測定したところ、経時的・濃度依存的に細胞内タンパク質がPEN化修飾を受けることがわかりました。またこの細胞モデルにおいて、顕著な細胞死は認められなかったことから、GlcAやPENに細胞死を誘導するほどの毒性はないことがわかりました(図1)。
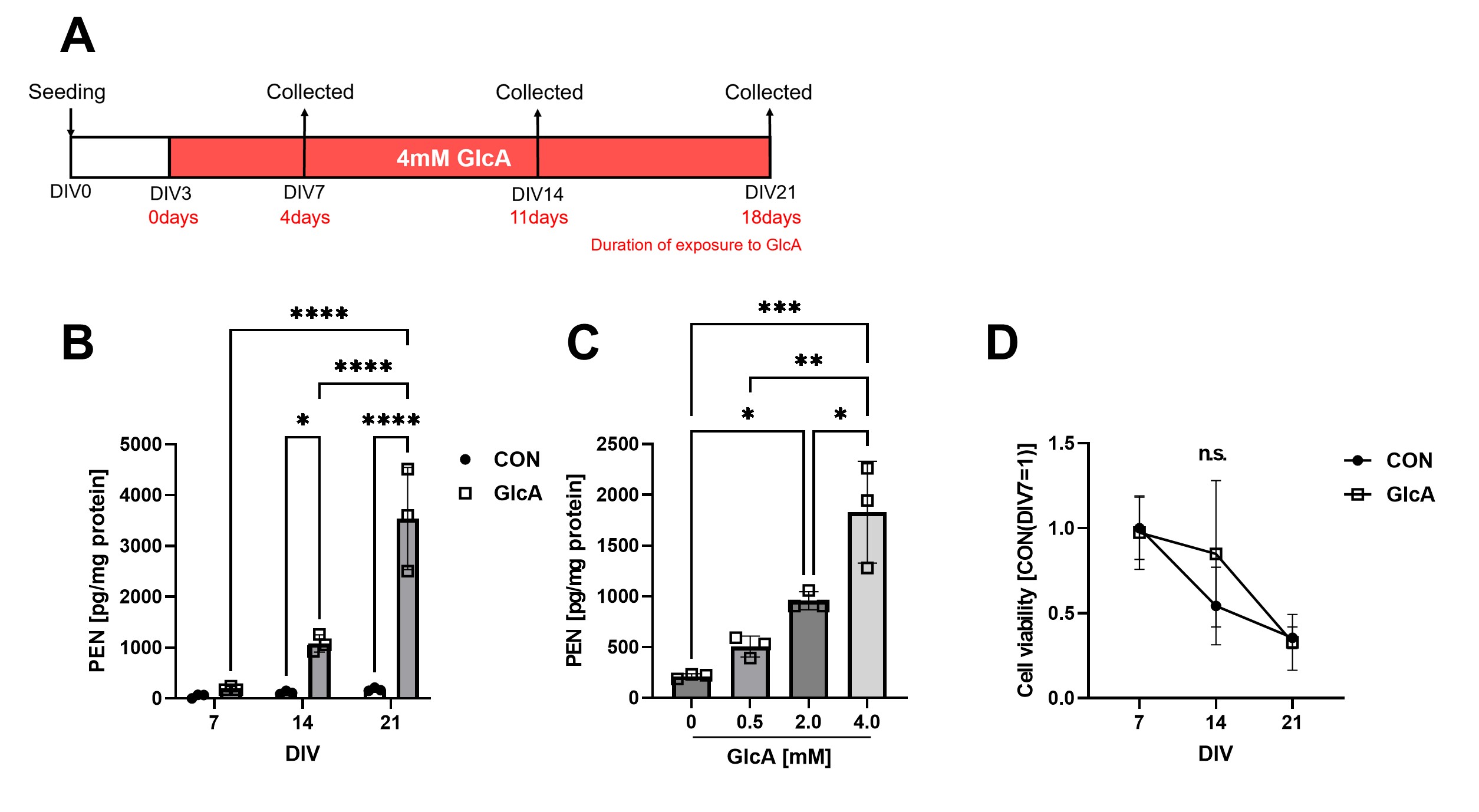
(A) PEN蓄積神経細胞作製のスケジュール。4mM GlcAをマウス初代神経細胞に添加し、最大21日間培養することにより作製した。 (B) GlcAを添加してから細胞内PEN化修飾タンパク質量を経時的測定した結果、時間依存的にPEN化修飾タンパク質の増加が認められた。(C)PEN化修飾タンパク質はGlcAの濃度依存的に増加した。 (D)細胞生存率の測定を行ったところ、GlcA添加細胞で顕著な細胞死は認められなかった。
次に、どのようなタンパク質がPEN化修飾を受けているのか、LC-MS/MSを用いて調べたところ、ヒストンやRac1活性制御因子が修飾を受けていることがわかりました。ヒストンのPEN化修飾は、ほかのPTM(翻訳後修飾)と競合し、遺伝子発現を変動させている可能性が考えられたため、RNA-Seqによる遺伝子発現解析を行ったところ、131遺伝子の発現変動が認められ、Gene Ontology Enrichment解析により、細胞外マトリックス関連遺伝子の発現が変動していることがわかりました(図2)。
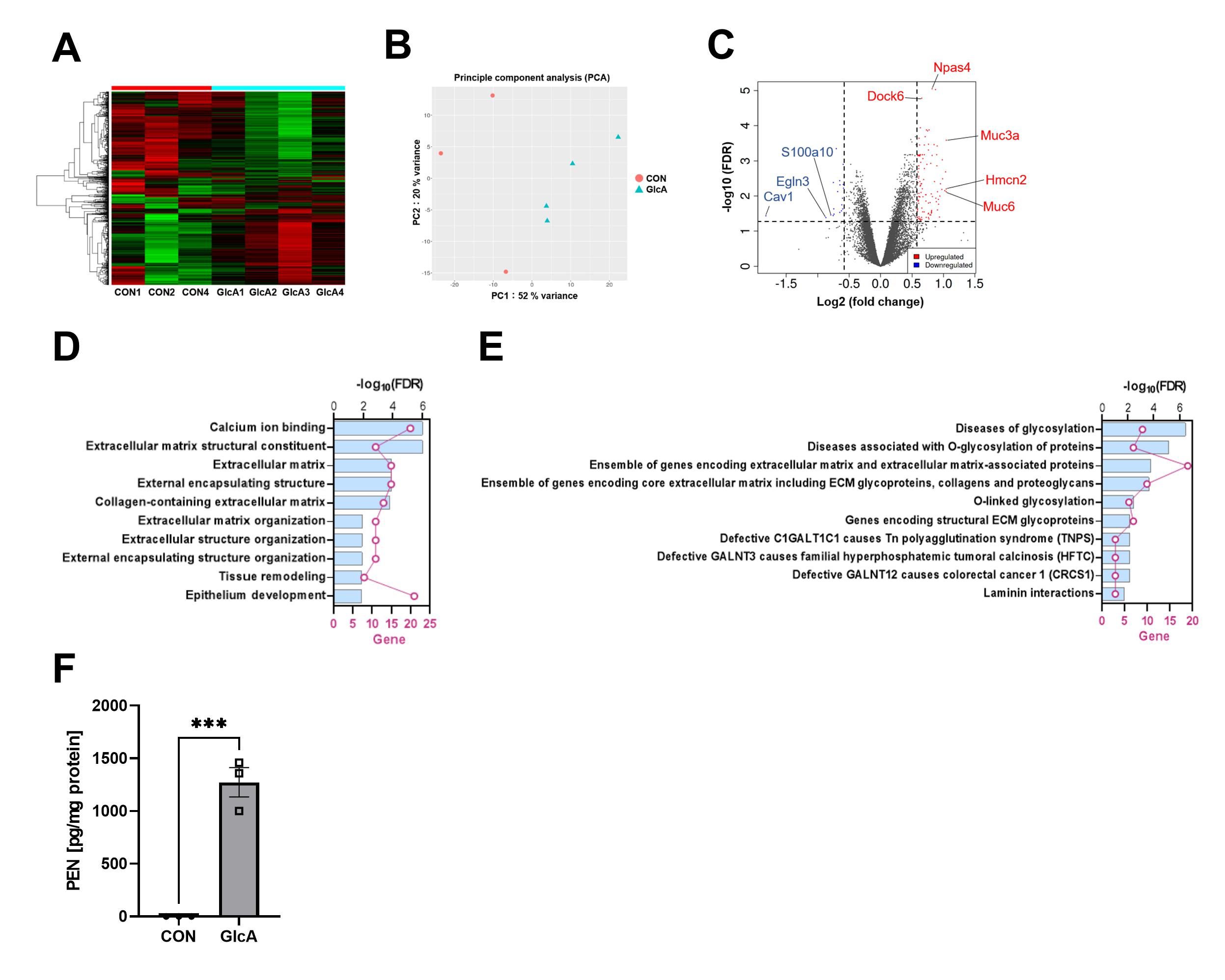
(A、B) ヒートマップやPCA解析の結果、PEN蓄積神経細胞では遺伝子発現変動が認められた。(C) 112個の遺伝子の発現上昇し、19個が発現減少することがわかった。 DEGsを用いた(D)GO 解析では細胞外マトリクス関連遺伝子、(E)Pathwayエンリッチメント解析では糖鎖修飾関連遺伝子が発現変動していた。 (F) ヒストン画分においてもPEN化修飾が起きていることを確認した。
細胞外マトリクスタンパク質の発現上昇、並びにRac1の活性変化は、共に樹状突起スパインの形態形成メカニズムに関与するため、次に、スパイン形態を観察しました。その結果、神経細胞内タンパク質のPEN化修飾は、スパインの密度や長さに影響を及ぼさなかったものの、幅を有意に増大させ、特に幅が1m以上のスパインの密度を増加させることがわかりました(図3)。
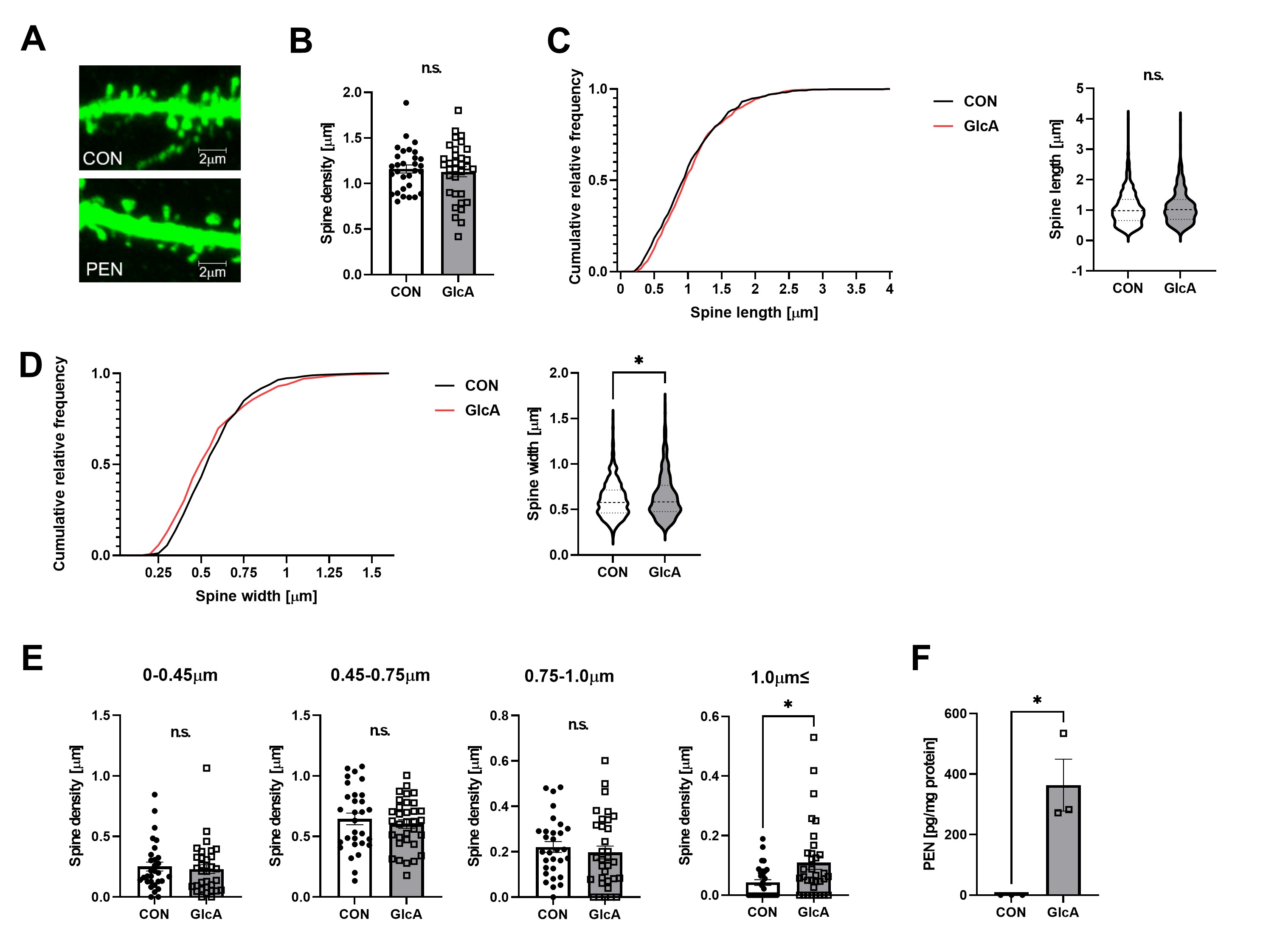
(A)マウス初代海馬神経細胞にGFPを発現させ、スパインの(B)密度, (C) 長さ (D) 幅の測定を行ったところ、密度・長さに変動はなかったが、幅が増加していた。 (E) PEN化修飾は、特に幅が1μm以上のスパインの密度を増加させた。(F)海馬神経細胞においてもタンパク質のPEN化修飾が増加していることがわかった。
最後に、この細胞モデルにおけるスパインの巨大化は、Rac1の活性化によるものなのかを調べるために、Rac1阻害剤(NSC23766)を添加し、スパインの形態を観察しました。この結果、Rac1阻害剤によって、PEN化修飾によるスパインの巨大化が抑制されることがわかりました。以上の結果より、タンパク質のPEN化修飾は、Rac1の活性化をもたらすことで、スパインの巨大化を引き起こすことがわかりました(図4)。
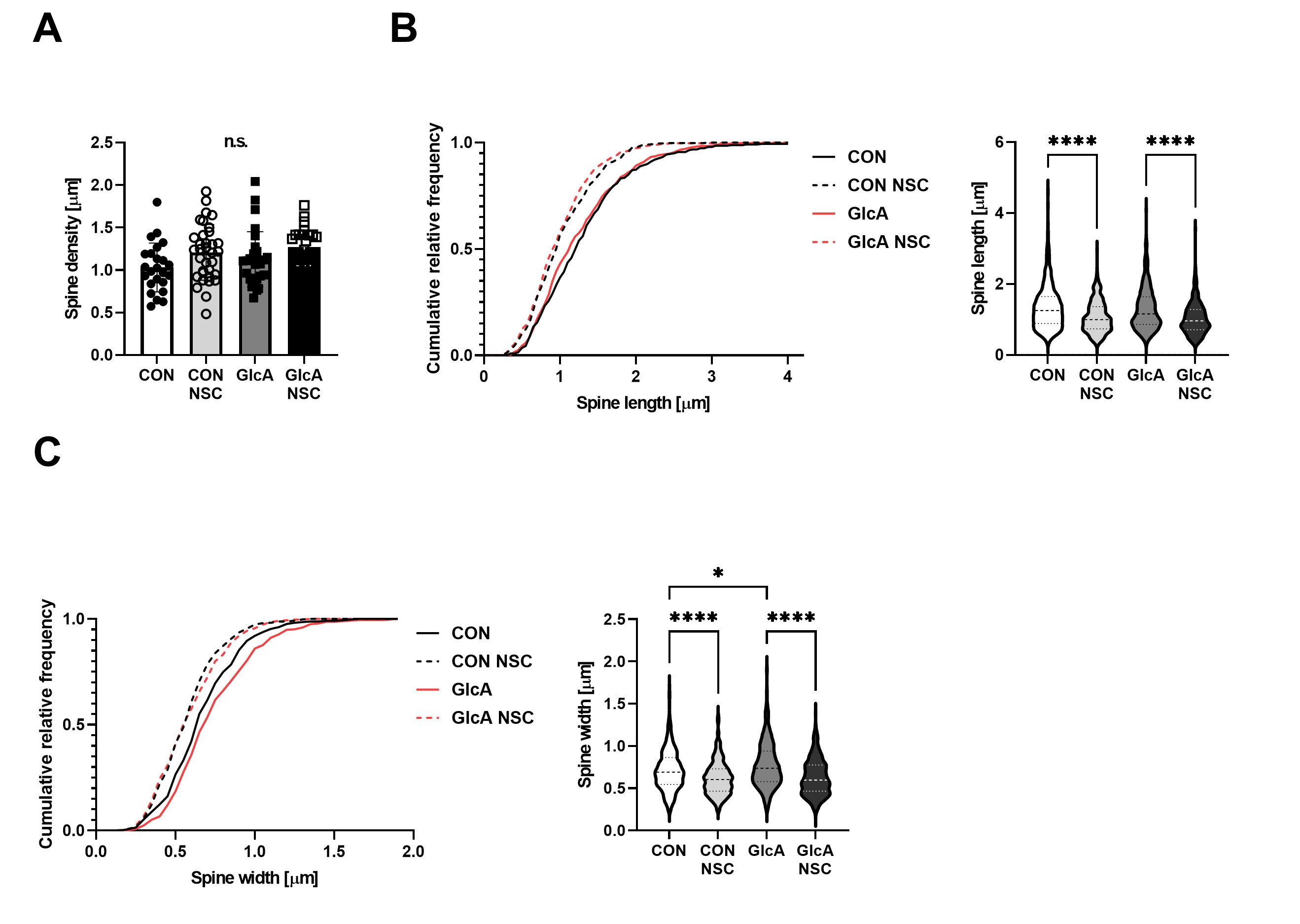
マウス初代海馬神経細胞にRac1阻害剤(NSC)を添加し、スパインの(A)密度, (B) 長さ (C) 幅の測定を行ったところ、GlcAで増加したスパインの幅がNSC処理で正常化した。
スパインの巨大化は近年同定された統合失調症の新たな病態であり、先行研究では統合失調症のリスク因子が巨大スパインの増加は神経細胞の発火頻度を増加させることで、認知機能障害を引き起こすことが報告されています[7]。 本研究では神経細胞内タンパク質のPEN修飾が、Rac1の活性化をもたらすことでスパインの巨大化を引き起こし、統合失調症の認知機能障害を引き起こす可能性を見出しました。今回明らかになった新たな統合失調症病態は、治療抵抗性を示すPEN高値の患者に対する、新たな治療薬開発につながる重要な知見を提供するものです。