Topics
研究成果
- 緑内障とアミロイドβの新たな関係を解明
-
NHK WORLD JAPANのMEDICAL FRONTIERSにおいて「研究成果14」の研究内容を紹介

- 視神経の再生に新たな可能性 ~DOCK3とHAUS7の連携が軸索再生を促進~
- DOCK3の構造変化を起こす低分子化合物による神経保護と軸索再生
- 緑内障モデルにおいて病態の進行を予防し、視神経を再生する、新しい遺伝子治療ベクター
- 網膜グリア細胞の機能異常が正常眼圧緑内障を引き起こす仕組み
- グリア細胞に発現するASK1が神経炎症を制御する仕組み
- DOCK-D family蛋白が神経炎症を制御する仕組み
- 日本人に多い「正常眼圧緑内障」を発症する、ヒトに近い緑内障モデルを発見
- DOCK8はミクログリアに発現して、神経変性を悪化させることを発見
- カロリー制限による網膜神経細胞死の抑制に成功
- 抗てんかん薬から緑内障治療薬へ
- グルタミン酸毒性による網膜神経細胞死の抑制に成功
- 薬剤による視神経損傷の軽症化に成功
- 網膜保護・再生の新たなメカニズムを解明
- 新規薬剤による多発性硬化症モデル動物の軽症化に成功
- 視神経の再生メカニズムを解明
- 世界初の正常眼圧緑内障のモデル動物を開発
– 米国科学雑誌「Journal of Biological Chemistry」において研究成果を発表 −
DOCK-D family蛋白が神経炎症を制御する仕組み
視覚病態プロジェクトの行方和彦 副参事研究員、原田高幸 参事研究員らは「DOCK-D family蛋白が神経炎症を制御する仕組み」について米国科学雑誌「Journal of Biological Chemistry」 に発表しました。
に発表しました。
研究の背景
多発性硬化症などの神経炎症疾患においては、炎症を制御する治療法の開発が求められています。研究グループでは昨年、免疫細胞に強く発現するグアニンヌクレオチド交換因子であるDOCK8が、神経系ではミクログリア特異的に発現し、神経炎症を増悪させることを報告しました。
DOCK familyには全部で11種類の蛋白がありますが、このうちDOCK-D familyに分類されるDOCK9、DOCK10、DOCK11(図1)については、詳しい機能がよくわかっていませんでした。
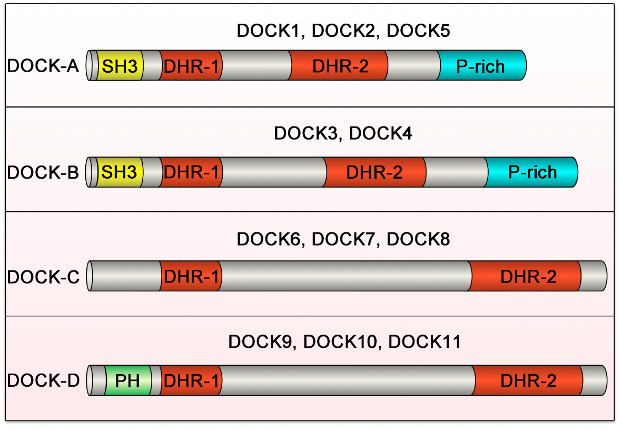
図1. DOCK family蛋白の構造と分類
DOCK familyは11の蛋白から構成されるが、分子構造の類似性から4つのサブグループ (DOCK-A, B, C, D)に分類される。
SH3, Src homology 3 domain; DHR, Dock homology region; P-rich, proline-rich region; PH, pleckstrin homology domain.
研究の概要
そこでDOCK9、DOCK10、DOCK11のそれぞれについて遺伝子欠損マウスを作出しました。これらを用いて多発性硬化症の疾患モデルを作製し、神経炎症の症状を調べました。その結果、DOCK10欠損マウスでは野生型マウスに比べて、脊髄炎による肢体麻痺が顕著に軽症化することがわかりました(図2)。一方、DOCK9およびDOCK11の欠損マウスには変化は見られませんでした。多発性硬化症の初発症状として、約20%の患者において、視神経の炎症(視神経炎)が観察されます。DOCK10欠損マウスでは、この視神経炎も軽症化することがわかりました。
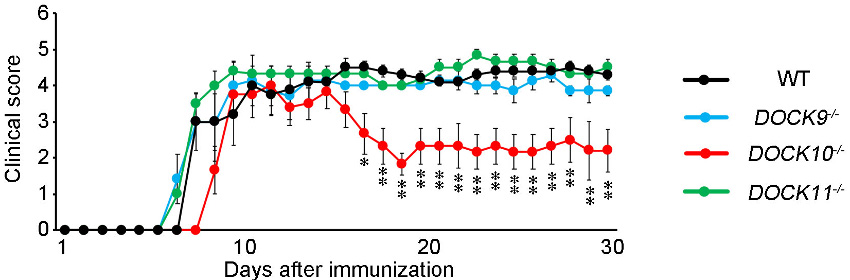
図2. DOCK10欠損マウスにおける脊髄炎スコアの軽症化
DOCK10欠損マウスの多発性硬化症モデル(赤線)では、野生型マウス(黒線)と比較して大きく軽症化することがわかる。
またDOCK10欠損マウスの病巣部をよく観察すると、T細胞やB細胞よりも、マクロファージやミクログリアという別の免疫細胞の集積が大きく低下することがわかりました。そこでDOCK10欠損マウスから取り出した培養マクロファージおよびミクログリアを調べたところ、両細胞の遊走性が野生型の細胞よりも低下することを発見しました(図3)。さらにDOCK10を欠損したアストロサイトではケモカインの1種であるCCL2の産生量が大きく減少しており、これが病巣部に炎症細胞が浸潤しにくい、もう1つのメカニズムであると考えられました。
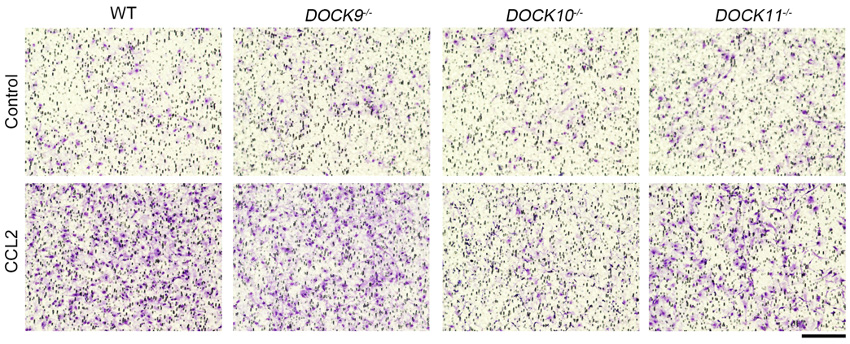
図3. DOCK10が欠損したマクロファージにおける遊走能の低下
ケモカインの1種であるCCL2依存性に、小さな孔のあいた膜を透過したマクロファージ(紫色)の細胞数を調べた。DOCK10欠損マクロファージでは野生型マクロファージと比較して、遊走性が大きく低下していた。
今後の展望
視神経炎や多発性硬化症には完全な治療法がなく、その再発も問題になっています。今回の結果はDOCK10が免疫細胞だけでなく、神経組織に存在するグリア細胞など、複数の細胞種の活性化を制御することによって、神経炎症を悪化させる可能性を示しています。したがって今後はDOCK8に加えてDOCK10が、神経炎症疾患の新たな治療標的となる可能性が期待されます。


