新型コロナウイルスや医学・生命科学全般に関する最新情報


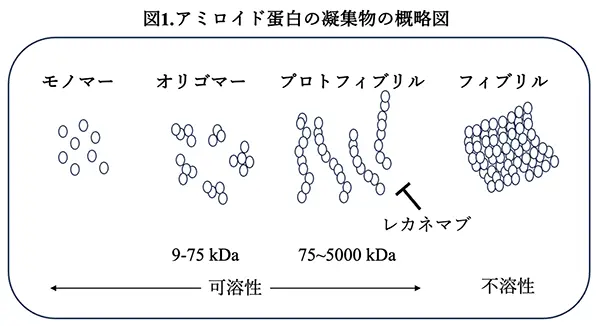
Aβの凝集が進むと最終的には不溶性線維(フィブリル)を成分とする老人斑が形成され、それがADの病態における神経毒性の原因となるのだろうというのが以前の考え方でしたが、近年は、フィブリルの神経毒性よりも、フィブリルに発達する過程の前段階に形成される可溶性オリゴマーやプロトフィブリル(図1)の神経毒性の方が強く、これらの分子が治療の標的になると想定されてきました。この概念に一致して、最近の第3相臨床試験でADにおける認知機能低下の進行を有意に抑えることが報告されたレカネマブは、Aβプロトフィブリルに選択的に結合し、脳内から除去することでADの病態進行を抑制する機序が示唆されています。従って、プロトフィブリルによる神経毒性のメカニズムをよりよく理解することが、今後、疾患修飾薬*4によるADの根治療法を確立する上で、重要な課題の一つになると思われます。これまで、プロトフィブリルなどの高分子オリゴマーが脳神経細胞膜に穴を開け、カルシウムを流入させ細胞内のカルシウム調節異常や、神経細胞を繋ぐシナプスの障害を引き起こすことなどが、主として細胞系で示されていますが、他のメカニズムに関しても調べる必要があります。このような状況で、米国ロックフェラー大学のStrickland博士らのグループは、ヒトの血清を用いて、Aβプロトフィブリルによって血漿接触システムが活性化され、さらにそれがレカネマブの存在下で抑制されるという興味深い現象を示しました。その結果がPNASに掲載されていますので、その論文(文献1)を紹介致します。
文献1.
A possible mechanism for the enhanced toxicity of beta-amyloid protofibrils in Alzheimer’s disease, Chen Z-L et al., Proc. Natl. Acad. Sci. U.S.A. 120 (36) e2309389120 (2023)
Aβは、その凝集の程度により、モノマー(単量体)、オリゴマー、プロトフィブリル、フィブリルなど異なる形態を呈する(図1)ことが知られているが、これまでの研究により、プロトフィブリルが最も神経毒性が高いことが示されてきた。しかしながら、その毒性増強のメカニズムは不明であり、これを明らかにすることを本論文における研究の目的とする。
我々は、接触システムがAβのプロトフィブリルによって優先的に活性化されると仮定する。これを証明するために、リコンビナントAβより、モノマー、オリゴマー、プロトフィブリル、フィブリルを調整し、これらのサンプルに対し、健康なドナーより採取した血清を用いて(n=8)、プルダウン・アッセイ、ウェスタンブロッティング、ブラジキニンELISA, XII因子の活性などを含むいくつかの解析を行った(詳細は文献1を参照して下さい)
本研究の結果は、ADにおけるAβプロトフィブリル毒性の考えられるメカニズムの一つが接触システムの活性化であり、レカネマブがADに対し、治療的に有効である理由を提供するものである。