COVID-19 ワクチン
COVID-19予防ワクチンの開発
COVID-19 とは
COVID-19(新型コロナウイルス感染症)は、2019年12月に中国の湖北省武漢市で初めて報告された、SARS-CoV-2によって引き起こされる感染症です。世界中に広がり、パンデミックを引き起こしました。咳や飛沫を介してヒトからヒトへ伝播し、感染が拡大します。高齢者や心臓病、糖尿病等の基礎疾患を持った人では、重症化しやすい傾向にあります。また、稀にではありますが、健康な成人でも重症例や死亡例が報告されています。子供への感染では、軽症であることが多いですが、子供から高齢者や基礎疾患患者への伝播に注意が必要です。
予防ワクチン
COVID-19のパンデミック以降、前例のないスピードで有効性の高いワクチンが次々と開発され、人への接種が実現しました。その中でも新しい技術で作られたmRNAワクチンの接種が、世界各地で急速に行われたことは、人類の感染症対策における大きな変革であったと言えます。COVID-19ワクチン接種が進んだことによって、重症化や死亡リスクを軽減できたと考えられます。しかし、現状ではCOVID-19が終息するとは考えにくく、今後も世界中でSARS-CoV-2感染が蔓延し続けると思われます。また、継続的に蔓延することによって、遺伝子変異を起こした新たなSARS-CoV-2の変異株が次々と出現し、周期的な流行を繰り返しています。流行株に対して、新たな変異株対応型mRNAワクチンが開発されていますが、2023年5月8日からCOVID-19の感染法上の分類を季節性インフルエンザと同じ「5類」に引き下げたこともあり、ワクチン接種率が低迷しています。今後も世界中で蔓延し続け得ることを考えると、強力に免疫を誘導し、かつ長期間免疫を維持できるワクチンを開発することで、ワクチン接種頻度を減らすことができ、人々の負担やワクチンへの忌避感を軽減できるのではないかと考えています。
COVID-19ワクシニアウイルスベクターワクチンの開発
変異に伴う抗原性変化にも対応し得る幅広い交差反応性を持つワクチンの開発が求められます。SARS-CoV-2のウイルス粒子表面にあるSpikeタンパク質は、mRNAワクチンをはじめ、多くのワクチンの標的抗原として使用されています。私たちはCOVID-19に対する新規の予防ワクチンとして、天然痘ワクチンであるワクシニアウイルスをさらに弱毒化したDIs株に、Spikeタンパク質遺伝子を導入した組換え生ワクチンを開発しました。このワクチンではワクシニアウイルスベクターを用いることによって、このワクチン接種後か ら短期間のうちに、ウイルスの細胞内への侵入を防ぐ抗体である中和抗体の産生や、免疫細胞であるTリンパ球の活性化が期待できます(図1)。マウスモデルを用いた試験結果から、組換え生ワクチンによって抗原変異にも対応可能な幅広い交差反応性を持つ免疫の誘導が期待できます(図2)。また、マウスモデルでは付与された免疫が長期にわたって持続することも判明しました(図3)。さらに、温度安定性が高いことから、冷蔵あるいは室温で保存および輸送が可能であるといった利点もあげられます。
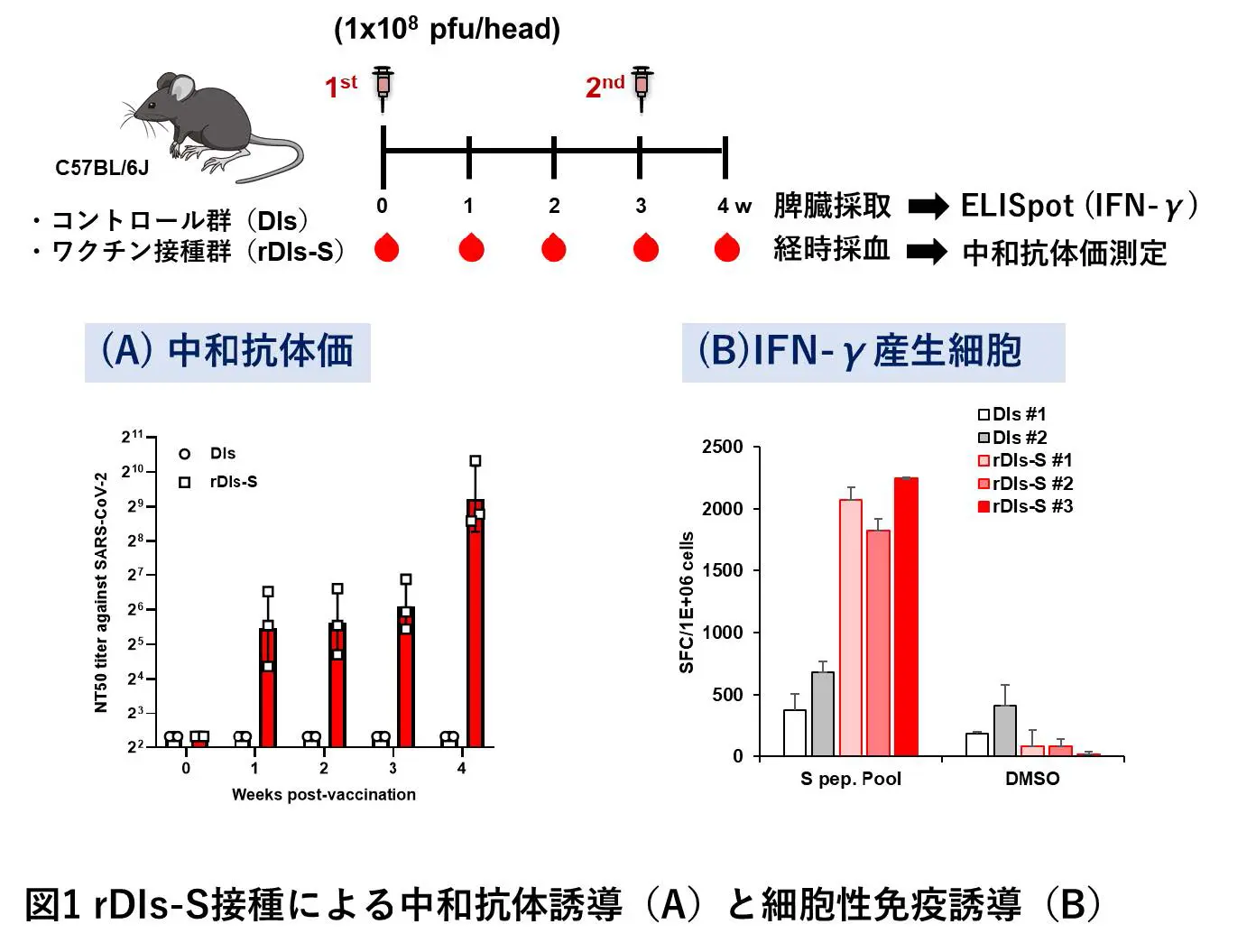
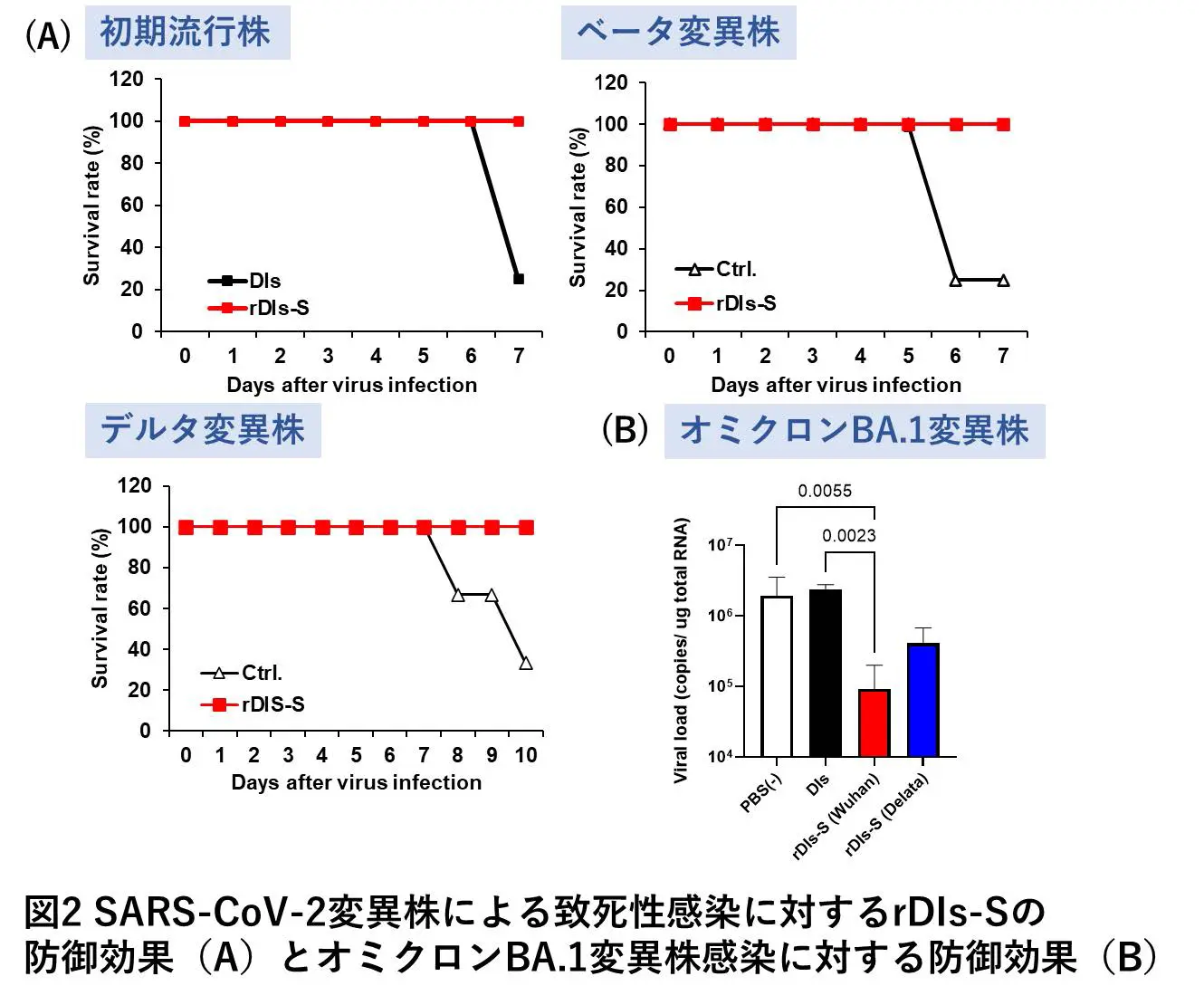
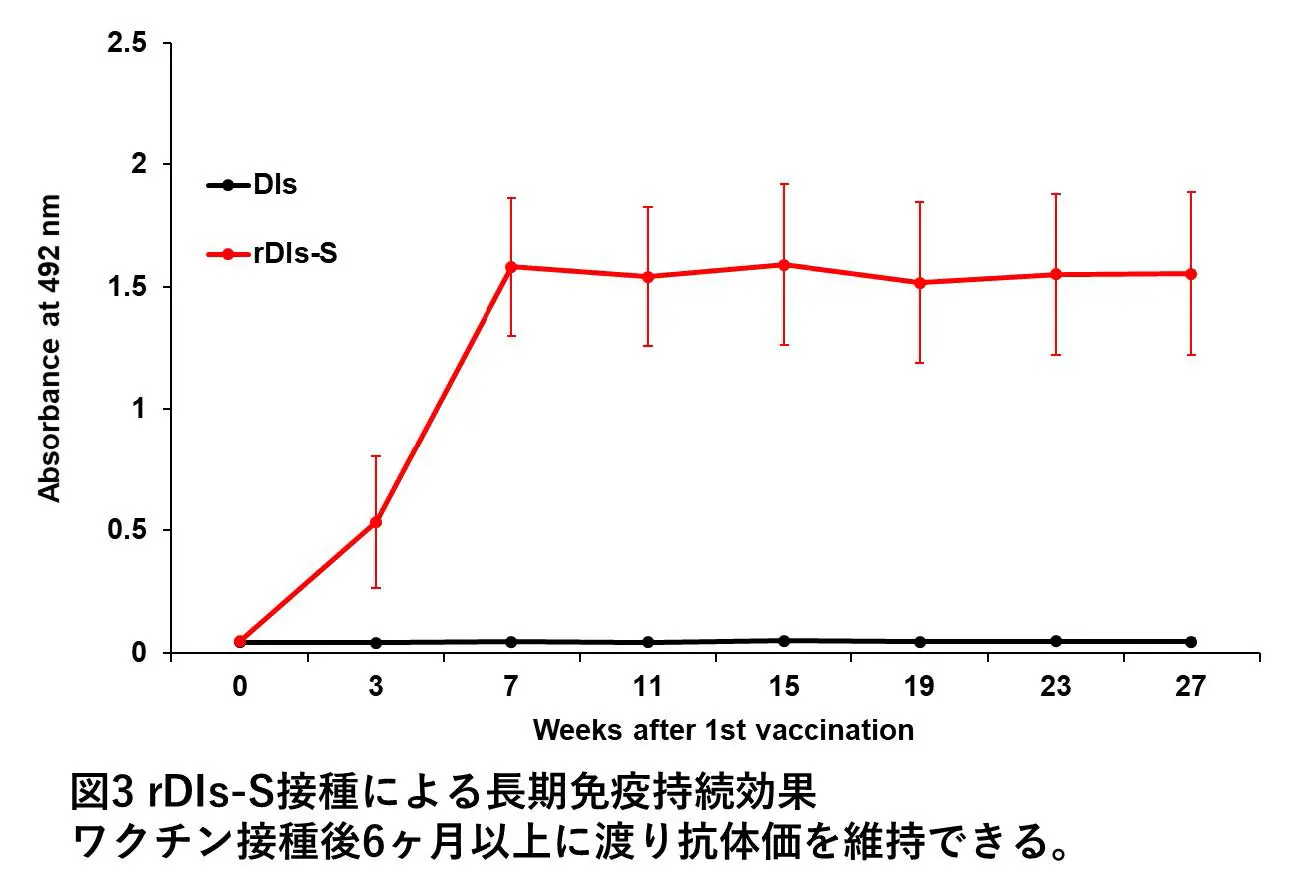
今後の展望
DIs株ベクターを用いたSARS-CoV-2ワクチンは、中和抗体および細胞性免疫を誘導する強い効果をもつ安全な予防ワクチンとなり得ることが示されています。今後は、様々な変異株に対して、より広範囲に防御効果を発揮するワクチンへと改良していきたいと考えています。新規COVID-19ワクチンの実用化を目指し、更にワクチン開発研究を進めていきます。
<発表論文>
- Ishigaki H, Yasui F, Nakayama M, et al. Front Microbiol. 2022. 13:967019.

