インフルエンザ
その他急性感染症研究(インフルエンザ)
インフルエンザとは
2009 年に起きたパンデミック H1N1 インフルエンザウイルス(H1N1pdm2009)の出現を含め、インフルエンザウイルスは過去に 4 度の世界的な大流行(パンデミック)を引き起こしています。過去に発生した世界的な大流行は、人類が免疫を持たない鳥や豚由来のインフルエンザウイルスの遺伝子がヒトの間で流行していたインフルエンザウイルスとの間で遺伝子の組換え(遺伝子再集合)が起こり、ヒト―ヒト間で伝播し、その後少しずつの遺伝子変異が起こりながら、毎年世界的に流行しています。
高病原性トリインフルエンザウイルス(H5N1 HPAIV)は野鳥間で伝播しており、ニワトリなどの家禽に感染した際に高い致死性を示します。また稀ではありますが、ヒトでの感染例と死亡例が報告されています。ヒトでの H5N1 HPAIV 感染は、致死率が 50%以上と非常に高いため、ヒトでの感染流行が危惧されています。H5N1 HPAIV の遺伝子は年々変異しており、抗原性の異なるウイルス株が多数存在し、その遺伝子配列から複数のクレードに分類されていることから、世界的大流行を引き起こすウイルス株を予測する事は非常に困難で、これらの変化に対応することが求められています。
高病原性トリインフルエンザウイルス感染に対する宿主免疫低応答性機序の解析
ヒトでの H5N1 HPAIV 感染は、東南アジア諸国とエジプトを中心に 900 人以上が報告されています。H5N1 HPAIV 感染では、肺組織中ウイルス量と重症化が相関し、ウイルスを排除できずに死亡している症例が多く存在します。
これまでに、高病原性発現に関わるインフルエンザウイルス蛋白質のアミノ酸変異が、複数報告されています。例えば、RNA ポリメラーゼ複合体の構成成分の一つである PB2 蛋白質の 627 番目のリジンへの変異は、哺乳類動物でのウイルス増殖性と致死性を高めます。また、非構造蛋白質である NS1 蛋白質はウイルス RNA 認識センサーである RIG-I と結合して抗ウイルス応答であるタイプ I インターフェロンの産生を抑制しますし、PB1-F2 蛋白質の 66番目のセリンへの変異もインターフェロン応答性遺伝子の発現抑制に関与すると考えられています。しかし、これら病原性発現に関わるアミノ酸変異を有していない H5N1 HPAIV 株も多く存在します。加えて、H5N1 HPAIV のヘマグルチニン(HA)蛋白質が有する多塩基性開裂部位は、ウイルスの全身指向性には関わるものの、肺組織での過剰なウイルス増殖への影響は不明です。従って、既知のウイルス因子のみでは、H5N1 HPAIV 感染による高病原性発現機序を完全には説明し切れていないと考えられます。
H5N1 HPAIV に対するワクチンは、従来の季節性インフルエンザと同一方法で作製されたスプリットワクチンでは抗体誘導能が非常に低いことが報告されています。また、H5N1 HPAIV 感染による重篤患者への快復患者由来の血漿投与による治療効果が報告されています。これらの結果からは、抗原特異的抗体が H5N1 HPAIV 排除に重要な役割を果たしていることを示唆しています。
H1N1pdm2009 感染したマウスでは、液性免疫産生時期に相関して肺組織中から急激に排除されるのに対して、H5N1 HPAIV 感染マウスでは、肺組織中ウイルス量が増加していき、重症肺炎を発症して死亡します。そこで、H5N1 HPAIV 由来 HA 蛋白質に対する抗体誘導能が低応答化する機序について解析を進めています。
組換え生ワクチンの開発
私たちは既存のワクチンとは異なる新規インフルエンザワクチンの作製を行っています。ヒトでの使用実績を有するウイルス母体に目的外来蛋白質を発現させた組換え生ワクチンは、高い安全性および優れた免疫誘導能を有しています。そこで、我々は、天然痘ワクチンとして日本で承認され、乳幼児に対して使用実績を有するワクシニアウイルス(LC16m8)や日本オリジナルの非増殖型高度弱毒化ワクシニアウイルス DIs 株を母体とした H5N1 HPAIV のヘマグルチニン蛋白質発現組換え生ワクチン(rVV-H5 HA)を開発し、モデル動物での防御効果を検討しました(図1)。パンデミック H1N1pdm2009 インフルエンザの世界的大流行からも分かるように一度新型インフルエンザがヒトの間で感染拡大が起こると短期間のうちに世界中に広がってしまいます。そこで、現状では限局的なヒトでの感染に止まっている H5N1 HPAIV やこれまでにヒト間で流行が起きていない新型ウイルスが万が一ヒト間で感染拡大が起こった際には、単回接種で短期間の内に強力に免疫誘導できるワクチンが必要であると考えられます。
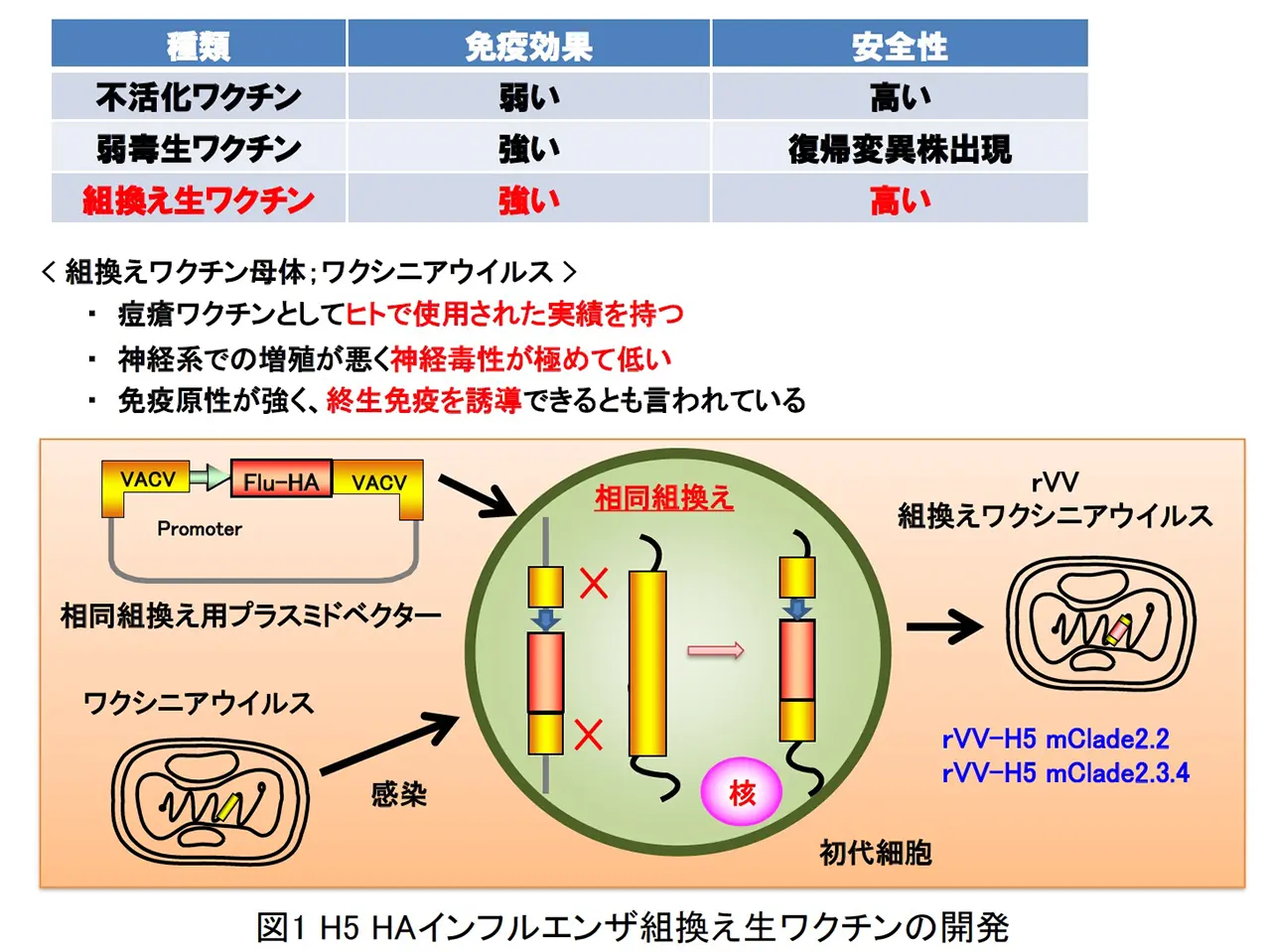
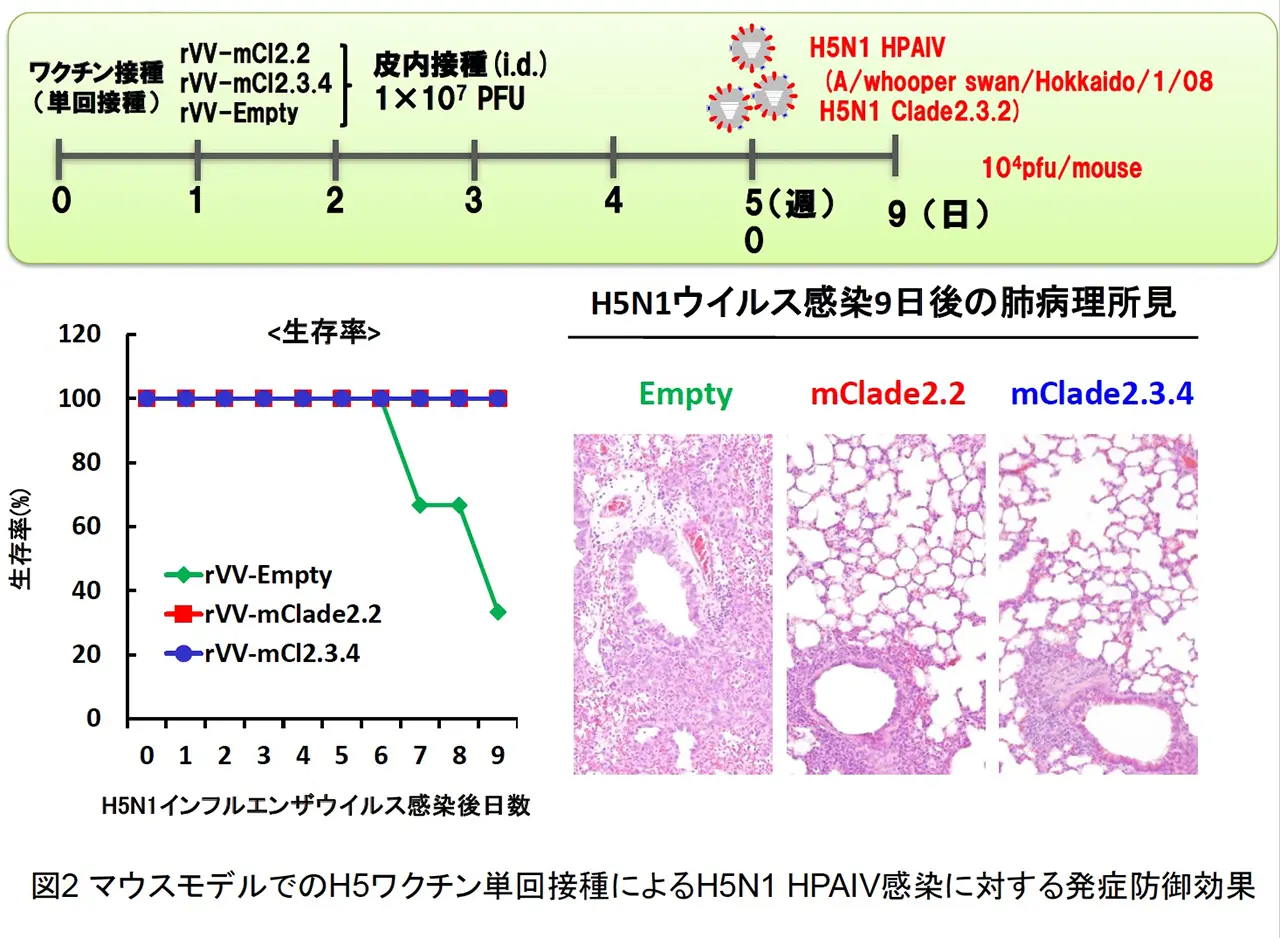
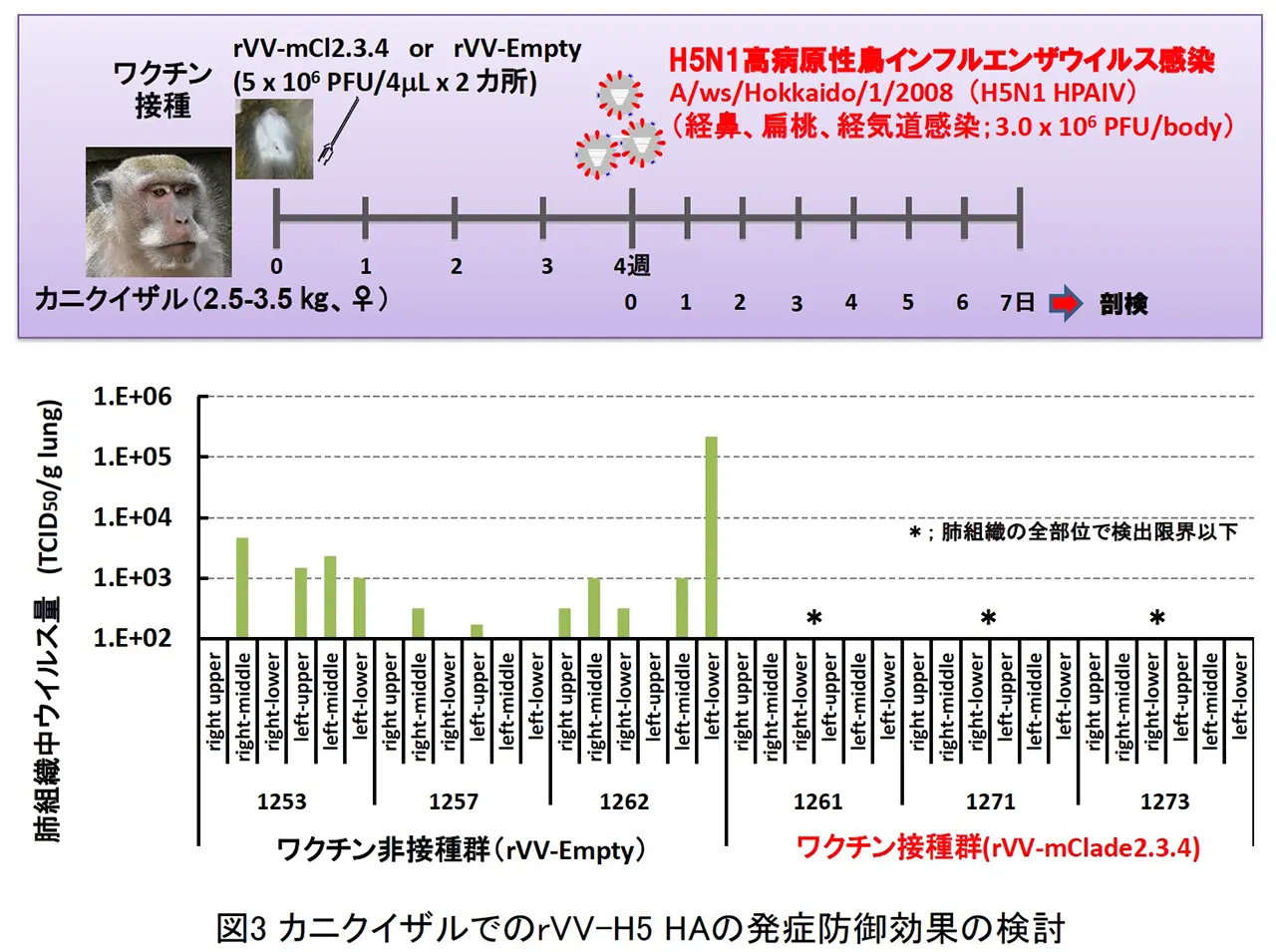
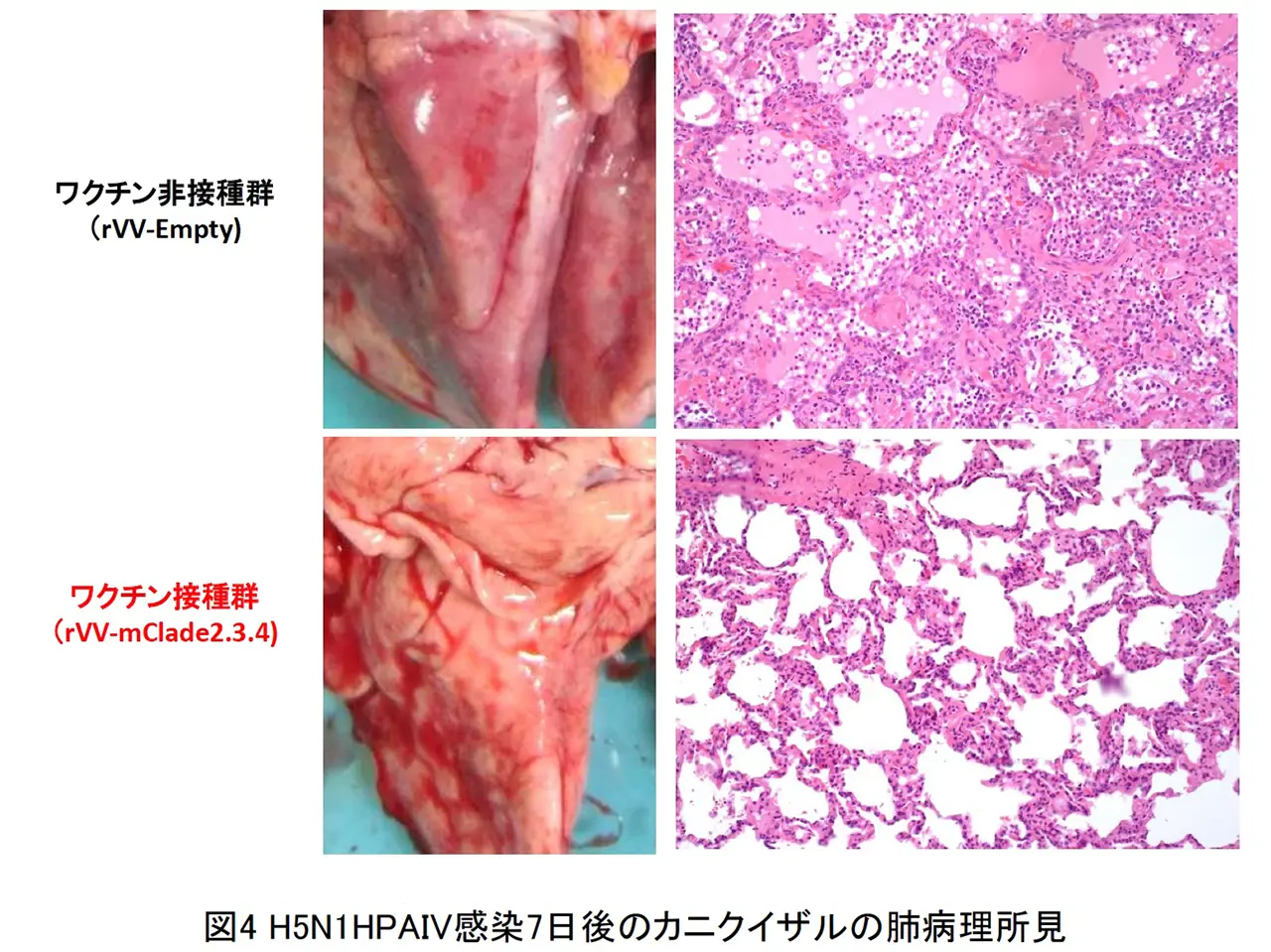
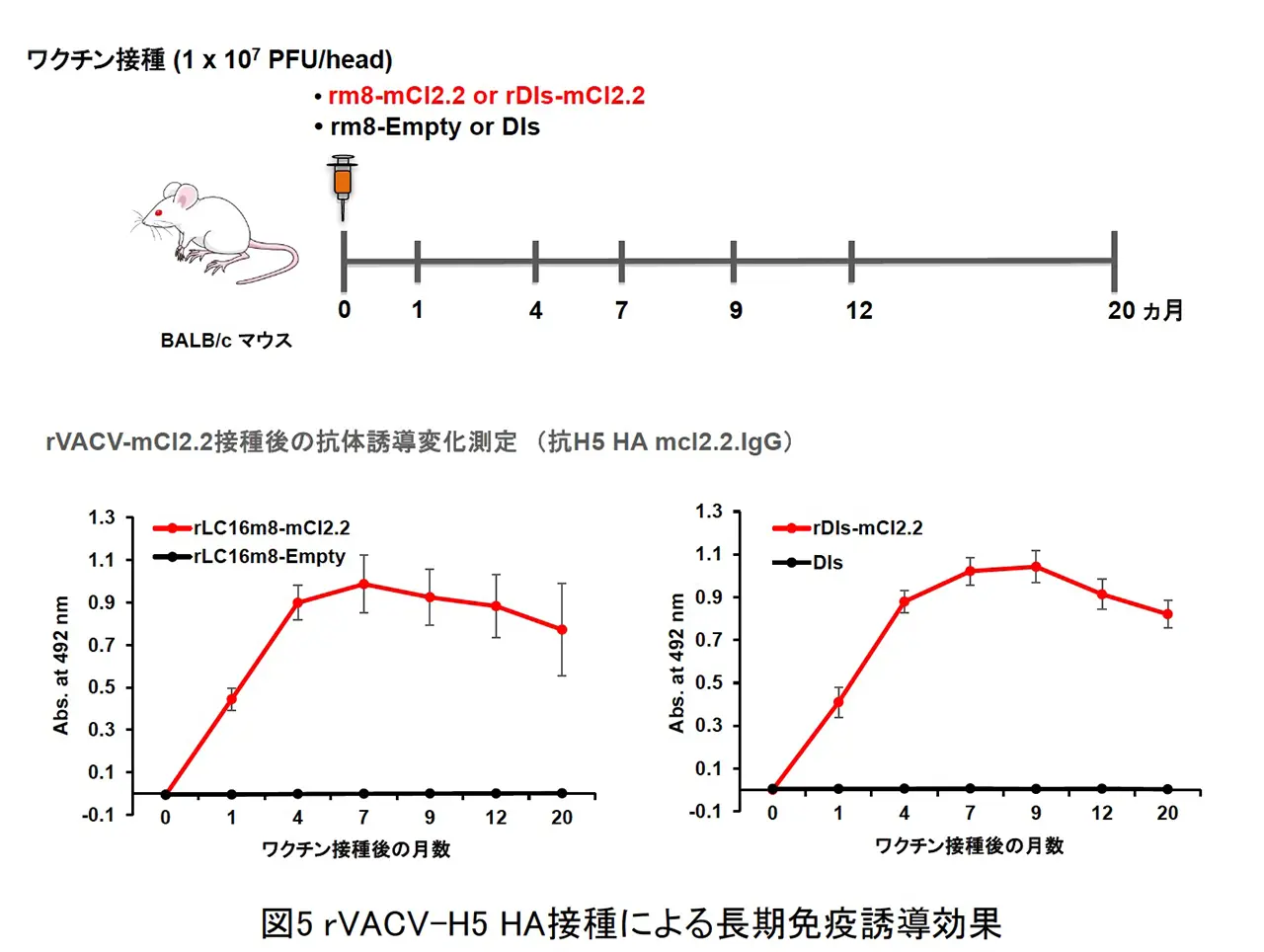
BALB/c マウスの皮内に rVV-H5 HA を単回接種し、その後 H5N1 HPAIV による致死性攻撃感染を行いました(図2)。ワクチン非接種では、重症肺炎を発症して高い致死性を示しましたが、ワクチン接種群では、肺炎像はほとんど認められず、100%の生存できる事が判明した。また、本ワクチンは、H5N1 HPAIV による攻撃感染の 1 週間前での単回接種で致死性ウイルス感染を100%防御できる事や国内で備蓄されている全粒子不活化H5N1プレパンデミックワクチンでは発症防御効果が弱いとされるクレードの異なるウイルス株に対しても強力な発症防御効果を発揮する事が明らかとなりました。また、霊長モデルであるカニクイザルでの本インフルエンザ組換え生ワクチンの防御効果を検討した結果、ワクチン接種群では、肺組織中からの速やかなウイルス排除効果と顕著な肺炎軽減効果が認められました(図3 と 図4)。さらに、LC16m8 株を母体とした組換えワクチンと DIs 株を母体とした組換えワクチンの両方の免疫持続期間について、マウスモデルを用いて検討した結果、哺乳動物細胞において非増殖型であるrDIs-mcl2.2 HAワクチンも rLC16m8-mcl2.2 HA と同等に長期免疫持続効果を示しました(図5)。以上の結果より、LC16m8 株母体と DIs 株母体の両方の rVV-H5 HA ワクチンは、H5N1 HAPIV の世界的流行に備えた有効なワクチン候補となり得ると考えられます。
今後の展望
今後は、これら組換え生ワクチンによる発症防御機序の解析を進めるとともに、近年北米などで流行しているウイルス株や将来発生する新たな出現株に対する有効性についても検証を行いたいと考えています。
<発表論文>
- Ogiwara H, Yasui F, Munekata K, et al. Am J Pathol.. 2014.184(1):171-183.
- Yasui F, Itoh Y, Ikejiri A, et al. Sci Rep. 2016. 6:37915.
- Yasui F, Munekata K, Fujiyuki T, et al. Vaccines (Basel). 2025. 13(1): 74.
抗体医薬を用いた治療法の開発
既存の抗インフルエンザ薬であるタミフルやリレンザといったノイラミニダーゼ阻害剤は、その効果が発症後 48 時間以内と限定的である事に加え、耐性ウイルスの出現が大きな問題となっています。治療が遅れた為にタミフル投与での治療効果が認められなかったH5N1 HPAIV 感染患者に対して、快復患者由来の血漿投与が劇的な治療効果を発揮したとの臨床報告は、抗インフルエンザ薬としての抗体医薬の可能性を示しました。
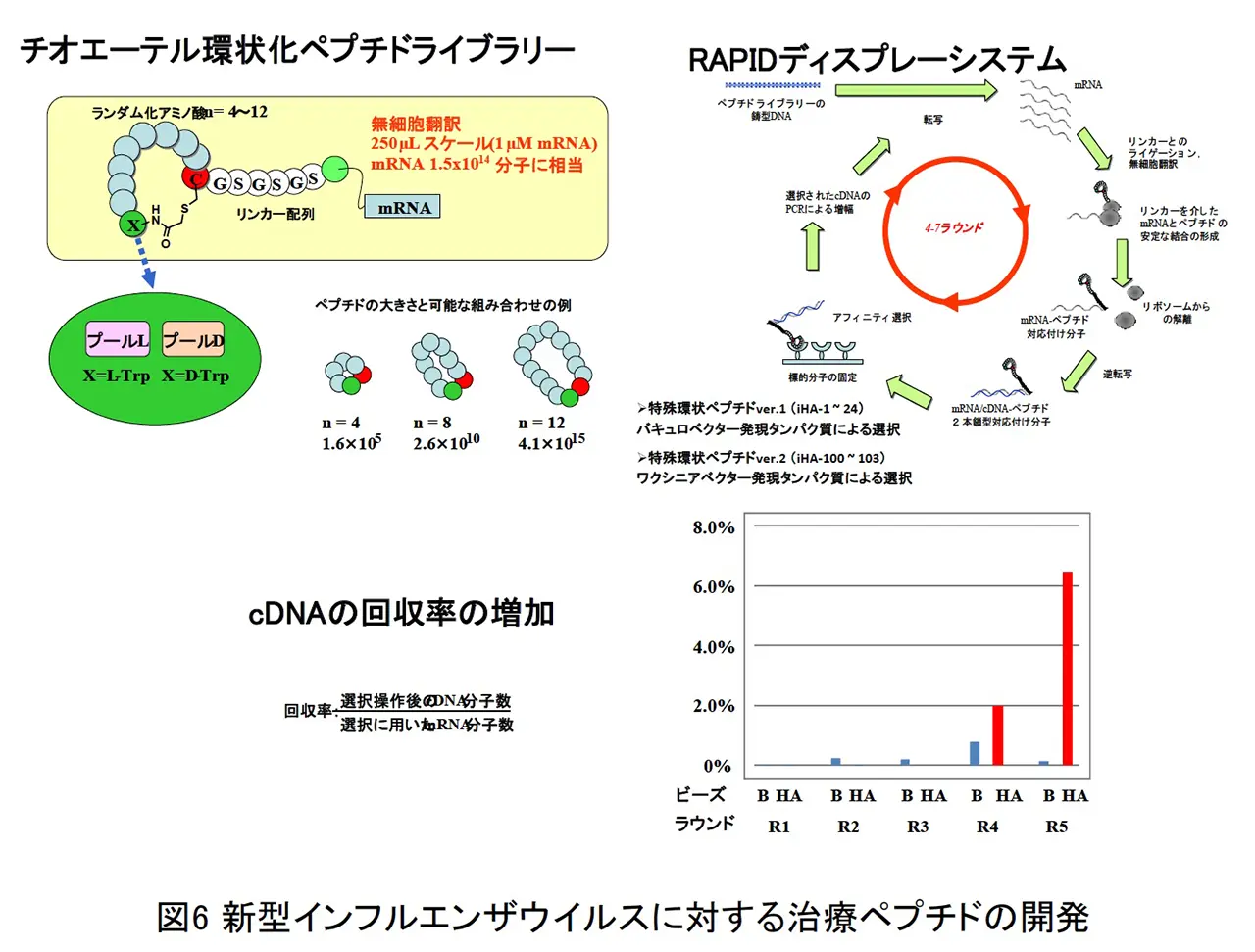
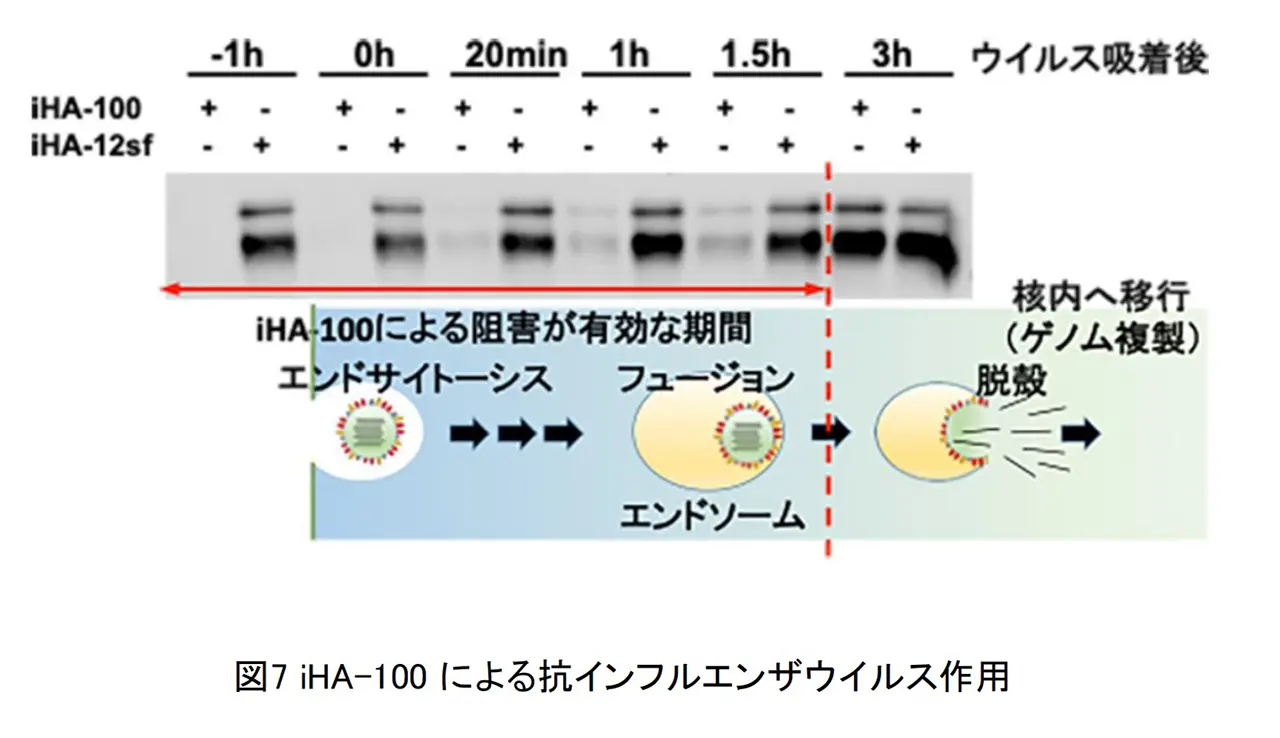
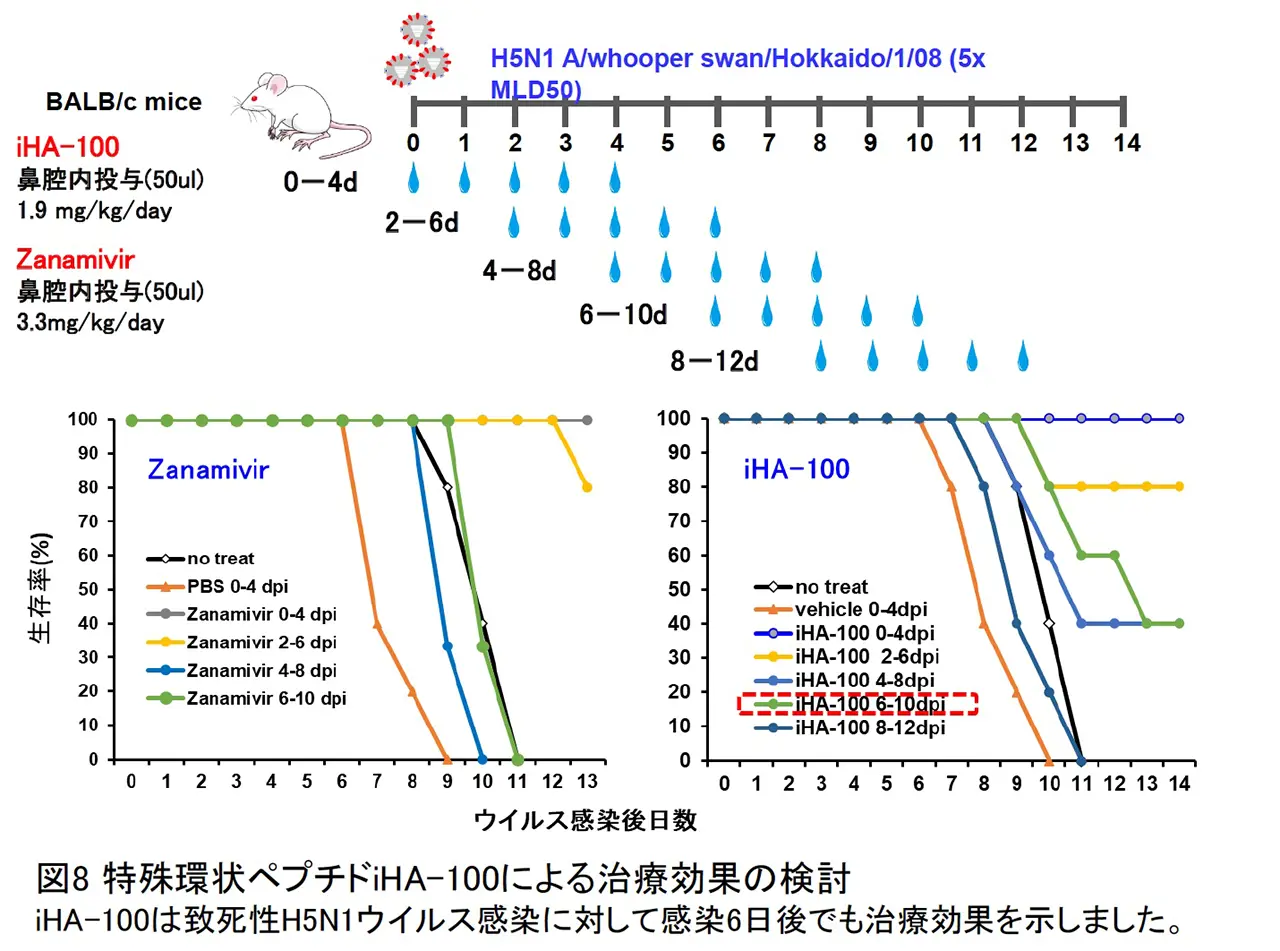
近年、第3世代の抗体医薬として特殊環状ペプチドが注目されています。特殊環状ペプチドは分子量が 500-2500 と小さく、立体構造上の障壁が大きい HA 蛋白質のストーク領域にも結合できる可能性があり、交差反応性が高くなることが期待できます。現行のインフルエンザ治療薬の多くは、ウイルス因子のノイラミニダーゼに対する阻害剤です。感染細胞からインフルエンザウイルスが出芽するのを阻害するという作用特性上、ウイルスが増殖した感染中期以降での阻害効果が顕著に減弱する事や遺伝子変異した薬剤耐性ウイルスが出現する事が問題点として挙げらます。私たちはこれまでにインフルエンザウイルスのヘマグルチニン蛋白質を標的とした特殊環状ペプチドの探索を行い、治療に用いられているリレンザと同等以上の阻害活性を有するペプチドを見出しました(図6)。この特殊環状ペプチドは H5N1/H1N1/H2N2 の 3 つの亜型に対して防御効果を発揮しました。さらに、この特殊環状ペプチドはリレンザ耐性のH1N1パンデミック 2009 に対しても強力な阻害活性を示しました。見出した特殊環状ペプチド iHA-100 がインフルエンザウイルス増殖を抑制するメカニズムを解明する目的で、ウイルス感染環のどこの段階を阻害しているかについて詳細な解析をおこないました。異なるタイミングで iHA-100 を培養上清に添加する実験をおこなったところ、iHA-100 の作用機序として、細胞外に存在するウイルス粒子の感染性を中和するだけでなく、細胞内においても HA と相互作用し侵入過程の複数の段階を阻害するといった新たな阻害機序が明らかとなりました(図 7)。更に、動物モデルを用いた治療実験において、感染初期にしか効果の無いリレンザとは異なり感染後期においても劇症肺炎抑制による治療効果があることがマウス及びカニクイザルの実験で確認されました(図8)。
今後の展望
今回見出した iHA-100 はウイルス粒子の感染性を中和するだけでなく、細胞内においても HA と相互作用し侵入過程の複数の段階を阻害するといった新たな阻害機序が明らかとなりました。また、感染 4 日後および 6 日後からの投与においても治療効果を示すことも明らかとなっており、Zanamivir(リレンザ)にはない治療効果を示していることから、新たな抗インフルエンザ薬としての可能性が示されました。
<発表論文>
- Saito M, Itoh Y, Yasaui F, Nat Commun. .2021. 12(1): 2654.

