COVID-19 病態モデル
SARS-CoV-2感染感受性マウスモデルの確立と病態解明および治療薬効能評価への応用
SARS-CoV-2感染動物の重要性
COVID-19の病態を解析する上で、SARS-CoV-2感染による発症機序の解明やワクチン・治療薬の効能評価には動物実験モデルが重要な役割を果たします。ところが、2019年から2020年にパンデミックを引き起こした当時の流行株は、研究で広く使われている購入可能な野生型マウス(BALB/cマウスやC57BL/6マウスなど)には感染しないため、研究が思うように進みませんでした。フェレットやゴールデンハムスターなど、SARS-CoV-2に感染できる動物モデルもありますが、遺伝子情報、免疫学的な解析ツール、遺伝子改変技術が最も充実しているマウスは、ウイルス学研究において最も重要性の高いモデル動物です。SARS-CoV-2の宿主受容体はヒトが持つアンジオテンシン変換酵素(hACE2)であり、マウスは類似ACE(マウスACE2:mACE2)を持っていますが、SARS-CoV-2とmACE2の親和性が高くありませんでした。そのため、マウスにSARS-CoV-2を効率よく感染させるため、大きく分けて次の3つの方法が用いられています。
- ヒト由来のACE2(hACE2)遺伝子をマウスのゲノムに組み込み、マウスの体内でhACE2が発現する遺伝子組換え(トランスジェニック)マウス(hACE2-Tgマウス)を用いる方法。
- 細胞に目的の遺伝子を導入する技術として、分子生物学研究などで広く使用されるウイルスベクターを使って、一時的にマウスの体内にhACE2を発現させる方法で、市販のマウスにSARS-CoV-2に対する感染感受性を持たせることできます。
- SARS-CoV-2をマウスの肺へ接種し、その肺から回収したウイルス液を次々とマウスの肺へ感染させ、継代することによって、マウスの体内で増殖できるSARS-CoV-2の変異ウイルスが出現します。この変異型SARS-CoV-2を用いる方法。
ヒトACE2発現改良型アデノウイルスベクターを用いた野生型マウスへのSARS-CoV-2感染感受性付与と病態解析
次から次への出現してくる新たなSARS-CoV-2の変異株の病原性を解析し、それら変異株に対する我々が開発しているワクチンの有効性を評価する上で、効率より研究が進められる方法として、2)のhACE2を導入したウイルスベクターを用いて、市販マウスへSARS-CoV-2感染感受性を付与する独自の実験系を構築することといたしました。代表的なウイルスベクターとして、アデノウイルスベクター、アデノウ随伴ウイルスベクター、レトロウイルスベクター、及びレンチウイルスベクターなどがあります。このうち、遺伝子発現効率が高いアデノウイルスベクターを用いることとしました。しかし、広く使用されているアデノウイルスベクターは、遺伝子発現が長時間持続しないことや細胞毒性があるなどの問題があります。そこで、細胞毒性が弱いことが報告されている改良型アデノウイルスベクターにhACE遺伝子を導入したhACE2発現改良型遺伝子組換えアデノウイルスベクター (rAd-pEF1α-hACE2-L)を作製しました。
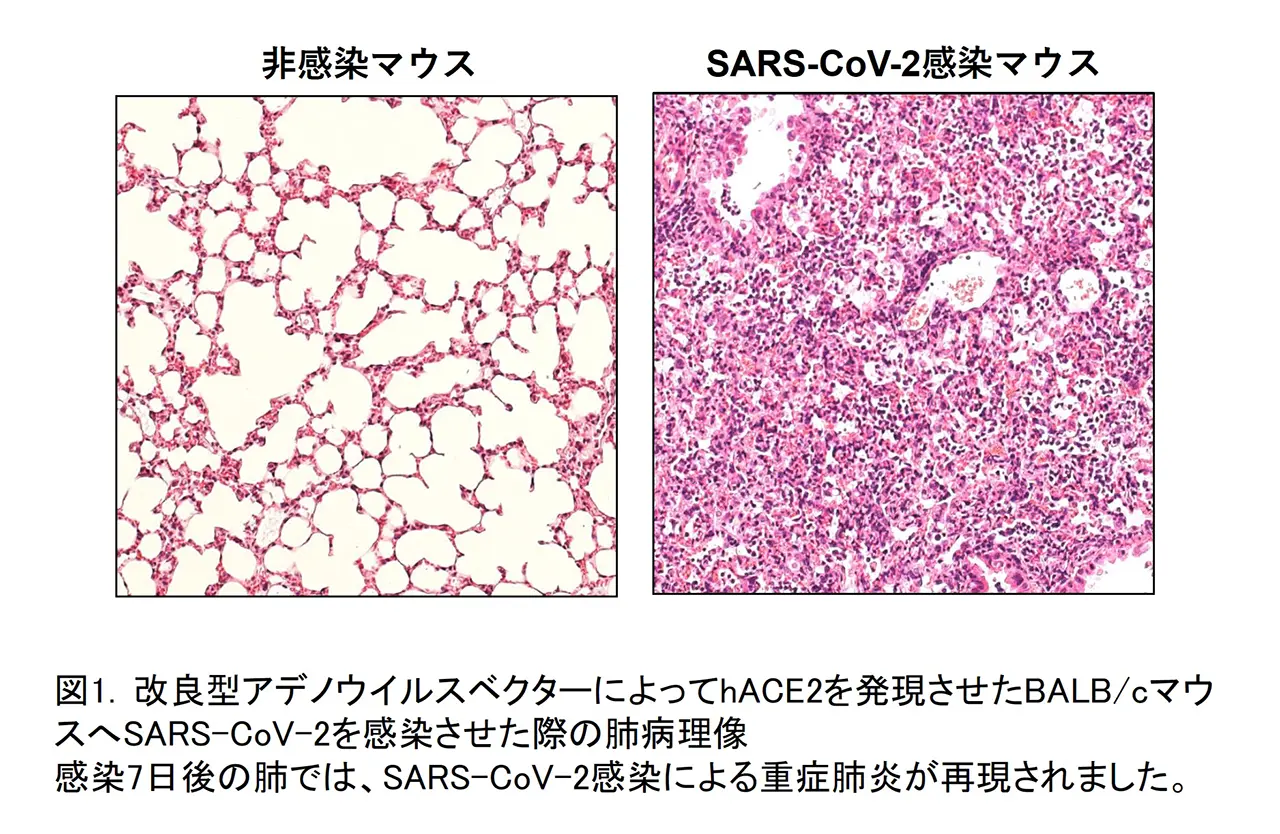
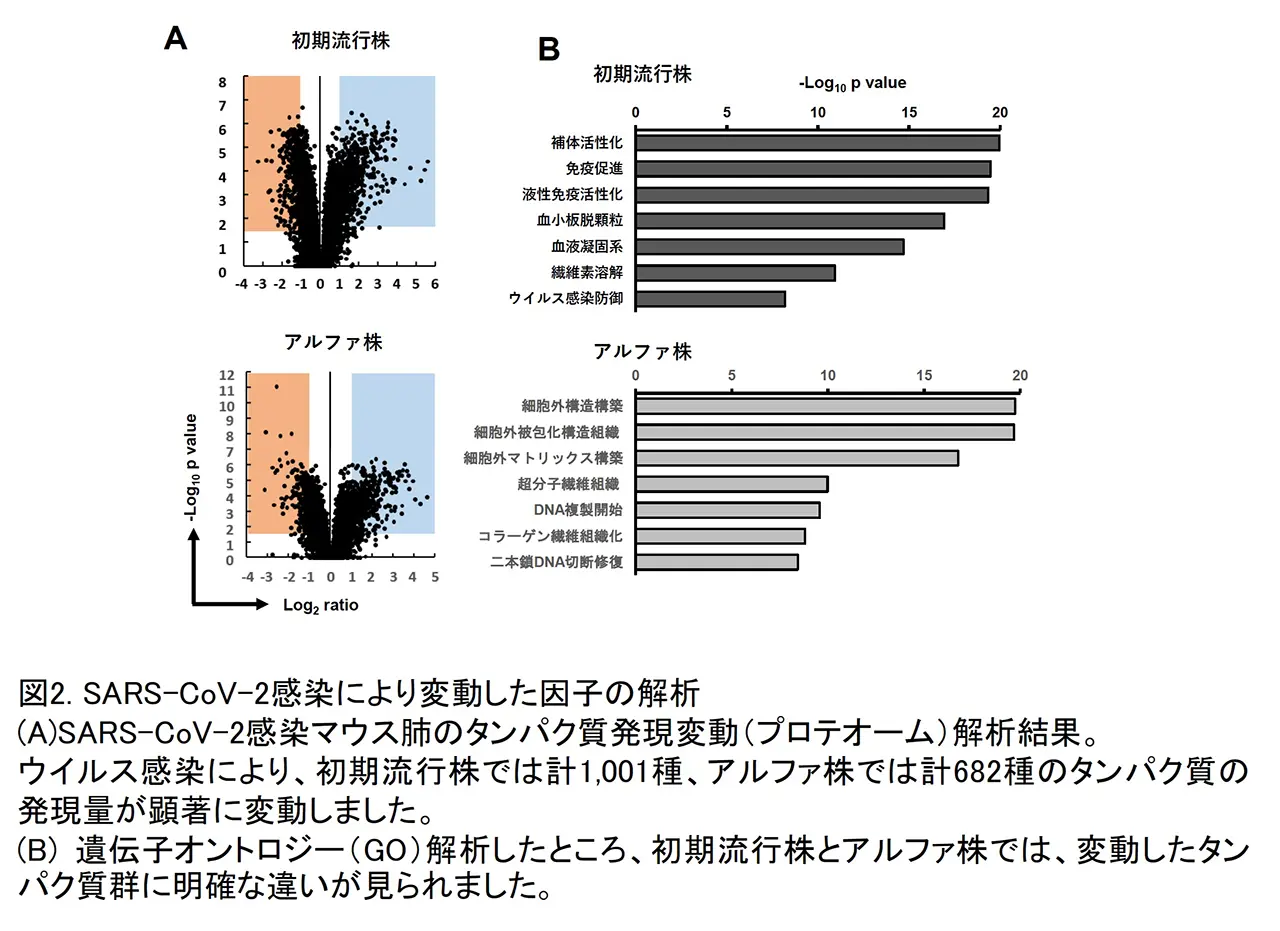
そのウイルスベクターをBALB/cマウスに経鼻接種した後にSARS-CoV-2初期流行株を感染させたところ、ウイルスがhACE2を発現したマウスの肺で効率よく増殖すること、感染した肺では早い時期からIL-6、IFN-gなどの炎症性サイトカインが産生されること、肺胞壁の肥厚化が起きていることを明らかにしました。SARS-CoV-2が感染した肺では、その後にマクロファージを主体とする炎症細胞の浸潤や出血及びうっ血が引き起こされました(図1)。続いて、SARS-CoV-2初期流行株とその後に出現した変異株(アルファ、ベータ、ガンマ株)の病原性を比較したところ、それぞれのウイルスごと増殖能力には大きな違いが見られませんでしたが、初期流行株に感染したマウスが最も大きく体重を減少し、最も重篤な肺炎となりました。肺炎の重症化機序を解明する目的で、感染マウス肺の検体を用いて、網羅的に宿主由来のタンパク質発現変動を解析(プロテオーム解析)した結果、初期流行株に感染したマウス肺では、免疫関連因子、特に補体系の顕著な活性化と血液凝固系因子の変動が認められました(図2)。また、感染の重症度と相関する因子として、Metallothionein-1/2、Tenascinを見出しました。
このrAd-pEF1α-hACE2-L 接種マウスはhACE2を受容体する各種SARS-CoV-2変異株による感染実験に使用できます。引き続き、様々なSARS-CoV-2変異株の感染によるCOVID-19病態を詳細に解析する実験動物モデルとして非常に有用であると考えています。また、このマウスモデルを用いて、ワクチン接種によるウイルス感染に対する防御御効果の検討やCOVID-19治療法の解析にも使用できます。
<発表論文>
- Matsumoto Y, Honda T, Yasui F, et al. Front Immunol. 2024. 15:1440314.
老齢BALB/cマウスを用いたSARS-CoV-2ベータ変異株の致死性感染モデルの解析
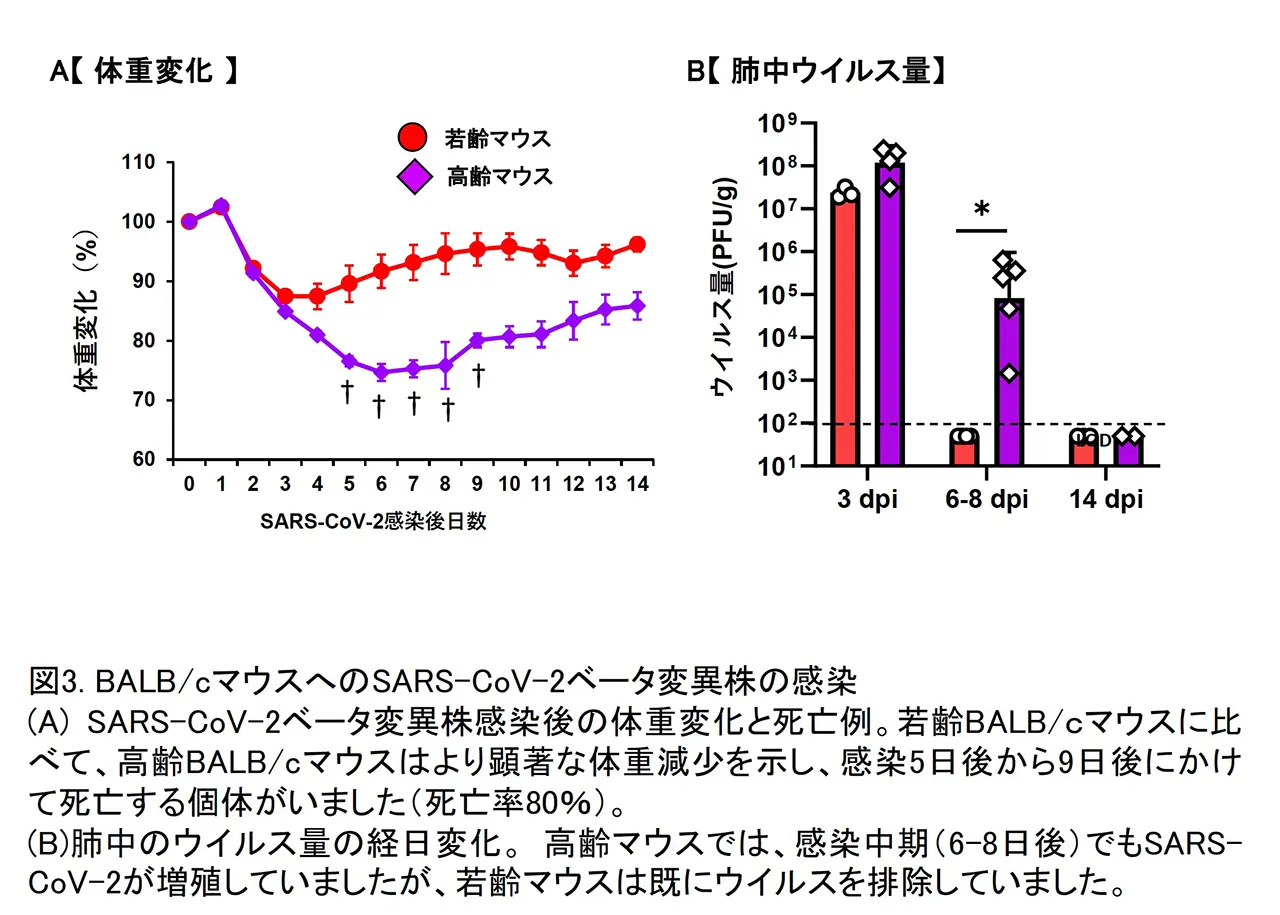
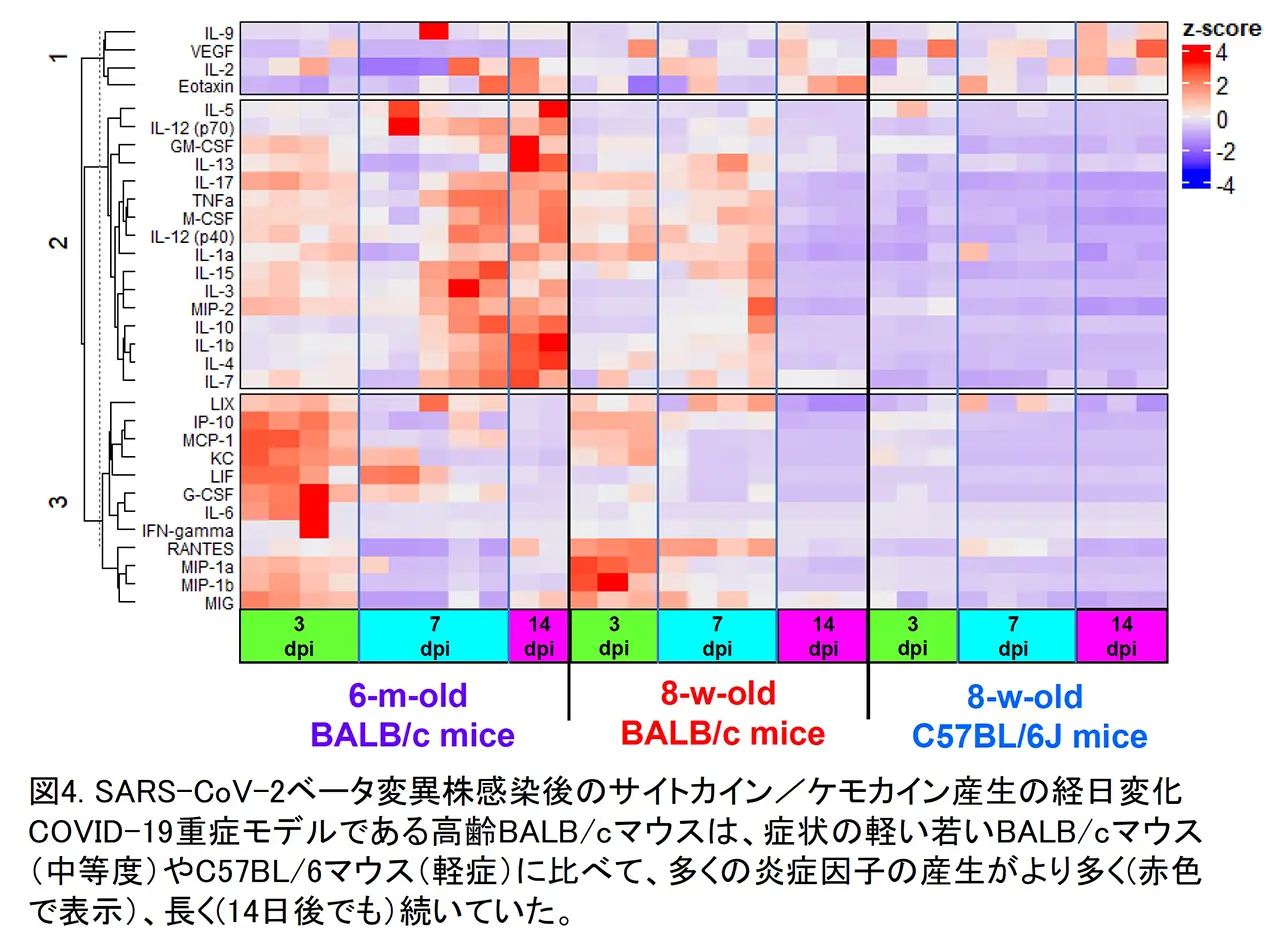
上で述べた通り、SARS-CoV-2の初期流行株が市販の野生型マウスに感染性を示しませんでした。しかしその後出現してきた変異株の中には、ウイルス粒子に表出し、宿主受容体との結合に重要な役割を果たすスパイクタンパク質に変異を持ち、マウスACE2(mACE2)に強い親和性を示すものが現れました。我々は、自然発生してきたベータ変異株が実験上強制的に樹立したマウス馴化SARS-CoV-2変異株と同一のアミノ酸変異をスパイクタンパク質の受容体結合領域に持つことに着目しました。患者由来SARS-CoV-2分離株(ベータ変異株)が市販の野生型マウスに感染し、病気を引き起こすかどうかを検討しました。市販の二種類のマウス(BALB/cマウスとC57BL/6Jマウス)に経鼻感染したところ、どちらのマウスの体重減少と炎症性サイトカイン/ケモカイン量の増加が認められました。また、C57BL/6マウスに比べて、BALB/cマウスでは肺でのベータ変異株がより多く増殖し、肺炎もより強く見られました。更に、高齢(6ヶ月齢以上)のBALB/cマウスにベータ変異株を感染させたところ、急激に体重が減少し、全身性の症状を伴って感染10日後以内に死亡しました(図3)。高齢BALB/cマウスでは、若齢BALB/cマウスよりも肺でのベータ変異株の増殖がより顕著であり、様々な炎症性サイトカイン/ケモカインが大量かつ持続的に産生されていました(図4)。今回の研究結果から、患者分離ベータ株を市販のマウスの系統とその月齢を変えることで、軽症から致死的まで幅広いCOVID-19症状を示すマウスモデルを構築することができました。
今後の展望
SARS-CoV-2ベータ変異株と二種類の市販マウスを組み合わせることで、COVID-19の症状の重症度に関連する因子の探索が可能になったと考えています。また、このマウスモデルは予防法や治療法の開発の応用研究にも役立ちます。
<発表論文>
- Yasui F, Matsumoto Y, Yamamoto N, et al. Sci Rep. 2022. 12(1):4150.

