医学・生命科学全般に関する最新情報


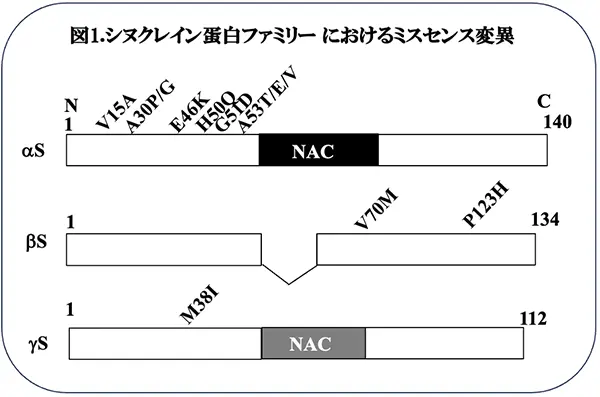
シヌクレイン蛋白ファミリーは、α-、β-、γシヌクレイン(α-、β-、γS)の3つの分子より構成されます。α-、及び、βSは、中枢神経系に高発現しており、パーキンソン病やレビー小体型認知症などのシヌクレイノパチー神経変性疾患との関係で研究されて来ましたが、γSは、元々、乳がん特異的遺伝子産物(BCSG1)*3として乳がんの組織より同定されましたので、主としてがんの領域で研究され、がん細胞の増殖、悪性化に関係するのではないかと考えられています。神経系においては、γSは、ALSの運動ニューロンや緑内障の網膜細胞に蓄積し、これらの神経細胞の変性を促進する可能性がある、すなわち、γSは神経変性とがんの両方の病態の進行に関与していると推定されましたが、詳しいメカニズムは不明でした。これまで、α-、βSに関しては、遺伝性のパーキンソン病やレビー小体型認知症においてミスセンス変異*4がいくつか同定されていますが(図1)、γSの変異に関する論文報告はありませんでした。今回、英国・リード大学のAubrey博士らは、家族性ALSの患者さん2例において、38番目のアミノ酸がメチオニンからイソロイシンへ変異しており(図1)、これに伴って、γSの蛋白凝集性が促進し、アミロイド・フィブリルを形成しやすくなることを見出して、PNASに報告しました(文献1)。本研究結果は、ALSの病態のメカニズムに対する理解を深め、治療法開発に向けたヒントになるかも知れません。
文献1.
Substitution of Met-38 to Ile in γ-synuclein found in two patients with amyotrophic lateral sclerosis induces aggregation into amyloid,Liam D Aubrey et al. Proc Natl Acad Sci USA 2024 Jan 9;121(2):e2309700120.
これまでの研究により、家族性ALSには、さまざまな遺伝子の変異が原因となることがわかっている。また、家族性、及び、孤発性ALSの病態には、TDP43の蓄積・凝集が中心であると考えられているが、他にも、銅・亜鉛-スーパーオキシドディスムターゼ(SOD1)*5やγSの蓄積・凝集も知られている。本プロジェクトでは、ALSの病態において、γSが蓄積するメカニズムをよりよく理解することを主な研究目的とする。
本研究の結果より、1つのアミノ酸置換でγSの凝集・蓄積が促進されることが示された。