※世界各国で行われている研究成果をご紹介しています。研究成果に対する評価や意見は執筆者の意見です。
一般向け
研究者向け
2023/3/7
新型コロナウイルス感染を食い止める受容体LRRC15
文責:橋本 款
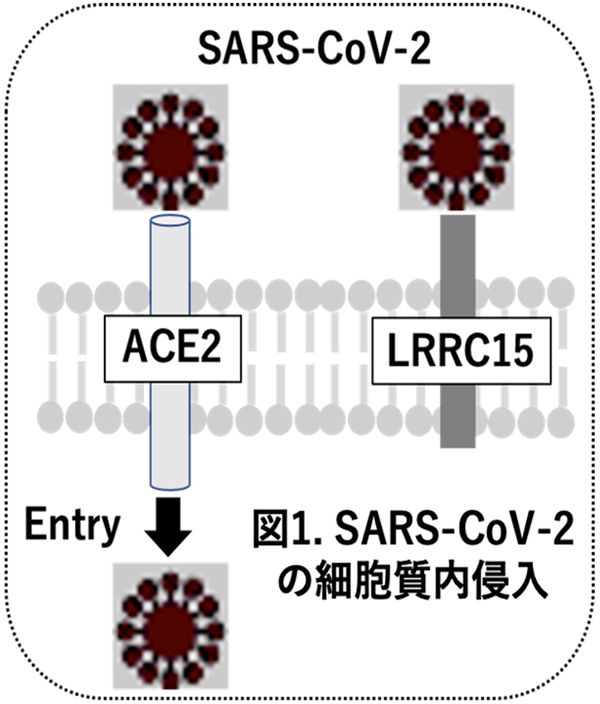
新型コロナウイルス(SARS-CoV-2)が細胞に感染する際、ACE2(アンジオテンシン変換酵素2)がその受容体として働くことから、これまで、ACE2によるウイルス侵入機構のメカニズムが精力的に研究されてきました。最近、興味深いことに、これとは対照的に、SARS-CoV-2に結合して細胞内へのウイルスの侵入を阻止し、感染が広まらないようにする細胞膜タンパク質が新型コロナ感染症(COVID-19)の研究領域で注目され始めています(図1)。今回、紹介致します論文(文献1)は、シドニー大学のLoo博士らが、Crisper Activation*1などの分子生物学的手法を駆使して、SARS-CoV-2のスパイクタンパク質に結合する分子としてLRRC15 (leucine-rich repeat-containing protein 15)を同定したものです。COVID-19にLRRC15がどう関わるかはこれから調べる必要がありますが、インペリアル・カレッジ・ロンドンのチームによる研究報告(Gisby JS, et al. Nat Commun. 2022;13:7775)では、COVID-19患者のLRRC15レベルを調べたところ、軽~中等症の経過を辿った患者の血漿では一定でしたが、重症化例では有意に低下しました。従って、LRRC15は重症化のマーカーとして使えるかも知れません。
文献1.
Loo, L. et al., Fibroblast-expressed LRRC15 is a receptor for SARS-CoV-2 spike and controls antiviral and antifibrotic transcriptional programs. PLOS BIOLOGY, Published: February 9, 2023
【背景・目的】
SARS-CoV-2感染における第一の受容体は、ACE2であるが、これまで、SARS-CoV-2のスパイク蛋白との結合を規定する宿主側の因子を体系的に評価した報告はない。従って、これを本研究の目的とした。
【方法】
Crisper Activationと蛍光標識したSARS-CoV-2のスパイクタンパク質に対する抗体を用いた、293細胞のFACS (fluorescence-activated cell sorting)解析を組み合わせることにより、全ゲノムレベルでのハイスループットスクリーニングを可能にする系を構築し、SARS-CoV-2のスパイク蛋白との結合を規定する宿主側の因子を評価した。
【結果】
- この実験系において、トップにヒットしたのは、トル様受容体(Toll-like receptor)関連のLRRC15であり、LRRC15の発現により、SARS-CoV-2のスパイクタンパク質の細胞膜への結合は促進した。
- LRRC15のmRNAは、肺のコラーゲン産生筋線維芽細胞に発現しており、LRRC15のタンパク質レベルでは、重度のCOVID-19に感染した気道に誘導されていた。
- また、LRRC15は、それ自体でSARS-CoV-2の感染を支持しないが、LRRC15を発現した線維芽細胞は、偽型*2、及び、本物いずれのSARS-CoV-2のトランスの感染を抑えた。
- 加えて、線維芽細胞におけるLRRC15の発現は、コラーゲンの産生を抑えて、IFIT, OASやMX-ファミリーなどの抗ウイルス因子*3 の発現を促進した。
【結論】
概して、LRRC15は、SARS-CoV-2のスパイクタンパク質に結合する新しい受容体であり、COVID-19感染におけるウイルスの負荷量を調節し、抗ウイルス、抗繊維化の転写プログラムを調節するのに役立つと思われる。
用語の解説
- *1. Crisper Activation
- CRISPR activation (CRISPRa)は、特異性の高い遺伝子過剰発現のための最適な方法である。CRISPRaは、不活化されたCRISPR-Cas9システム (dCas9)を用いて、ターゲット遺伝子をアップレギュレーする。この方法は、cDNAやORFなどの従来の遺伝子過剰発現技術に比べて多くの利点がある。
CRISPRaの利点
- 一過的または持続的に遺伝子過剰発現が可能
- CRISPRベースの遺伝子標的特異性
- 遺伝子のネイティブコンテキスト内でのアップレギュレーション
- ナチュラルな細胞内転写後処理
- 生物学的に適切な過剰発現モデル
- *2. 偽型(シュードタイプ)
- レトロウイルスは細胞由来の脂質二重膜にそれぞれのウイルスによりコードされているエンベロープタンパク質を発現している。このエンベロープタンパク質は標的細胞膜上に存在する受容体を特異的に認識するため、ウイルスが感染できる細胞を決定する重要な因子の1つとなっている。このエンベロープタンパク質を別のウイルス由来のものに変更することをシュードタイプいい、ウイルスの性質を変えることができる重要な手段である。
- *3. IFIT, OAS, やMX-ファミリーなどの抗ウィルス因子
- IFIT (interferon-induced proteins with tetratricopeptide repeats)、OAS (2'-5'-oligoadenylate synthetase)、MX-ファミリーは、いずれも自然免疫系の抗ウイルス因子であり、インターフェロンによって誘導される。
今回の論文のポイント
- LRRC15は、SARS-CoV-2のスパイクタンパク質に結合する新しい受容体であり、COVID-19感染におけるウイルスの負荷量を調節し、抗ウイルス、抗繊維化の転写プログラムを調節するのに役立つと思われます。実際、LRRC15が阻止するウイルスは他にもあり、アデノウイルス感染に対するLRRC15の抑制効果が以前に示されています。
- 今後、LRRC15は、マーカーとしてのみならず、COVID-19の予防や重症化阻止に適用できることが期待されます。
- 文献1
- Loo, L. et al., Fibroblast-expressed LRRC15 is a receptor for SARS-CoV-2 spike and controls antiviral and antifibrotic transcriptional programs. PLOS BIOLOGY, Published: February 9, 2023


