医学・生命科学全般に関する最新情報


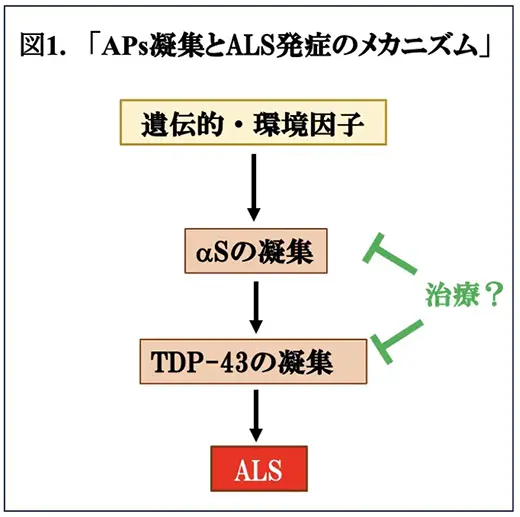
神経変性疾患の病理学的な特徴の一つは、言うまでもなく、アミロイドタンパク質(AP)の凝集・フィブリル形成ですが、興味深いことに、ある神経変性疾患において特異的なAPと共に、他の神経変性疾患に特異的とされる別のAPも凝集することがあります。ALSにおいては、i) インビトロ(試験管内)において、ALSなどに特異的なAPの一つのTDP-43の凝集はパーキンソン病に特異的に凝集するαSにより促進する、ii) ALSの患者さんにパーキンソニズムの症状が見られることがある、iii) ALSの剖検脳の解析でレビー小体(封入体)が観察されることがある、iv) グアムや紀伊半島には、ALSとパーキンソン認知症を複合する疾患が多発する、などの多くの結果に基づいて、ALSの病態促進にαSが関与する可能性が想定されてきました。最近のアルツハイマー病の治験における抗アミロイド免疫療法の成功を考慮すれば、TDP-43などAPの凝集は治療の標的になる可能性があり、TDP-43の凝集のメカニズムをより深く理解することは重要です。このような状況で、米国カリフォルニア・ラホヤにある神経学研究所のR. Smith博士らは、CSFをαSのシード増幅アッセイで解析したところALS患者さん由来のCSFから高い活性を観察しました。このことは、ALSにおいて、αSによるクロスシーディング*2がTDP-43の凝集促進の原因となっている可能性を示唆しており(図1)、ALSの治療に応用できるかも知れません。この結果は、Eur J Neurol.に掲載されましたので、今回はその論文を紹介いたします(文献1)。同論文は、最近のNature Review Neurology(Fyfe I, 2024)にも取り上げられ注目されています。
文献1.
Misfolded alpha-synuclein in amyotrophic lateral sclerosis: Implications for diagnosis and treatment, Smith R et al., 2024, Eur J Neurol. 2024 Apr;31(4):e16206.
イン・ビトロの実験系において、TDP-43の凝集はαSのオリゴマーやプロトフィブリルにより促進する、さらに、ALSの患者さんに振戦、筋肉の硬直などパーキンソニズムの症状が見られることがある、ALSの剖検脳の解析でレビー小体(封入体)が観察されることがある、などの結果に基づけば、ALSの病態促進にαSが関与する可能性が仮定される。この仮説に対する結論を出すのが本研究の目的である。
この目的のために、ALSの患者さんのCSFにおけるαSのシード活性をシード増幅アッセイで解析した。サンプルは、家族性ALS、孤発性ALS、グアムALS、健常者が含まれた。
以上の結果より、ALSのサブグループのCSFにおいて、プリオン様に自己複製するαSが検知されたことから、αSがALSの病態に関与していることが推定される。この知見は、ALSの診断と治療に有意義であると思われる。