医学・生命科学全般に関する最新情報


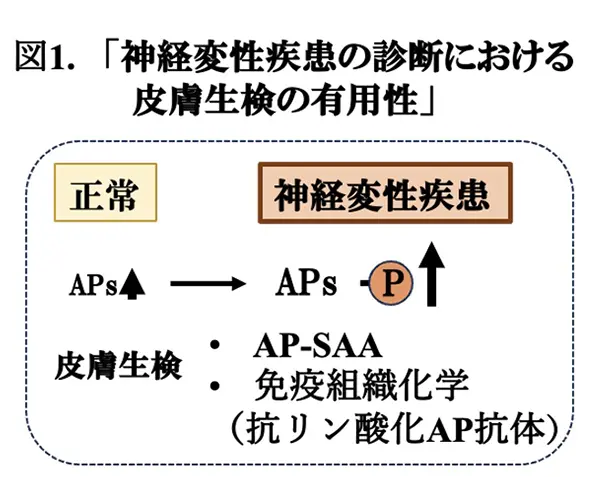
PDなどの神経変性疾患の症状は多彩であり、鑑別診断に困難を伴うことがあります。現在、臨床的な診断を確定出来るのは、患者さんの剖検脳の病理解析が唯一の手法と言っても過言ではありません。そのため、PDに特異的かつ感度の高いバイオマーカーの同定は、重要な研究課題として位置付けられ、精力的に研究が行われています。近年、SAAと呼ばれる試験管内でタンパク質凝集体の形成速度を観察する手法が、脳脊髄液のサンプルを対象としたα-シヌクレイン(αS)凝集体の検出にも応用されています。もし、SAAを非侵襲的に得られる組織のサンプルに対して定量的な解析に使えることができれば、PDの鑑別診断に使えるかも知れません。この様な状況で、中国・広州医科大学のYaoyun Kuang博士らは、PD患者さんとPD以外の患者さん由来の皮膚を最も明確に区別するSAAの条件を150通りの中から決定し、その結果、αS-SAAが高い感度と特異度でPD患者と対照群の健常人を識別できる可能性が示されました(図1)。また、PDの病態では、αSのリン酸化がαSの凝集促進に関与していることが知られています。米国・ハーバード大学のChristopher H. Gibbons博士らは、抗リン酸化αS抗体を用いた皮膚切片の免疫組織化学解析でPDだけでなく, 他のαシヌクレイパチー;レビー小体型認知症(DLB)、多発性萎縮症(MSA)など、にも高率に診断できることを示しました(図1)。以上の結果は、PDや関連疾患の診断における皮膚生検の有用性を示唆するものであり、それぞれ、npj Parkinson’s disease誌(文献1)、JAMA誌(文献2)に掲載されましたので、今回はそれらの論文を紹介いたします。多くのアミロイドタンパク質(APs)は、プリオン用伝搬*3、過剰リン酸化を特徴とし、皮膚で発現していますから、同様な知見を得ることが出来るかも知れません。
文献1.
A skin-specific α-Synuclein seeding amplification assay for diagnosing Parkinson’s disease, Yaoyun Kuang et al., npj Parkinson’s disease, volume 10, Article number: 129(2024)
SAAは、臨床的に利用できる種々の標本においてαSの凝集体を検出する貴重な手法である。その効率性、特異性にも関わらず、PDとPD以外とを区別する組織特異的な最適条件は、まだ、決められていない。本プロジェクトは、皮膚生検のサンプルを用いて、これを明らかにすることを研究目的とする。
この研究では、後継部部位より採取した皮膚に対して、150通りのSAAの条件の中からPDとPD以外を最も明確に区別するものを系統的に同定することにより、SAAの修正を行う。
本研究は、皮膚のサンプルを用いたPD診断に対して、サンプルの調整、凝集物の増幅、及び、貯蔵の手法を徹底的に研究し、しっかりとした実験的な枠組みを導入するものである。
文献2.
Skin biopsy detection of phosphorylated α-synuclein in patients with synucleinopathies, Christopher H. Gibbons et al., JAMA, 2024;331(15):1298-1306.
PD、DLB、MSA、純粋自律神経不全症(PAF)*5などのα-シヌクレイノパチーにおいて診断マーカーを同定することは、喫緊の課題である。α-シヌクレイノパチーの病態では、αSのリン酸化がαSの凝集促進に関与していることが知られている。本プロジェクトの研究目的は、抗リン酸化αS抗体を用いた皮膚切片の免疫組織化学解析によるリン酸化αSの検出が、敏感で特異的なα-シヌクレイノパチーの診断テストになることを示すことである。
2021年2月から2023年3月にかけて行われた全国30ヶ所のアカデミック、コミュニティーベースの横断研究。PD、DLB、MSA、 または、PAF の診断を受けた40~99歳の患者さん、及び、α-シヌクレイノパチーの診断を受けてない同年代の参加者に対して、皮膚生検(後継部部位)を行い、抗リン酸化αS抗体を用いた免疫組織化学解析を行なった。
この横断研究では、PD、DLB、MSA、PAFのいずれにおいても皮膚政権の結果リン酸化αS の検出率は高かった。さらなる研究を行い、任意抽出の臨床人口において外部的に検証する必要がある。