医学・生命科学全般に関する最新情報


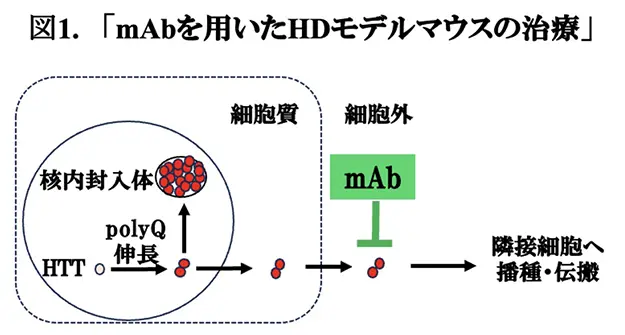
これまでお伝えして来ましたように、アミロイド蛋白に対するMabを用いた受動免疫による疾患修飾治療の確立を目指して、アルツハイマー病(AD)の患者さんに対する第3相臨床試験が成功し、続いて、パーキンソン病(PD)でも、現在、臨床治験が精力的に行われています。その他の神経変性疾患においても、神経毒性のあるアミロイド蛋白凝集物の除去が治療の目的になりますから、ほぼ同様の研究の流れで進んで行くものと予想されます。これらの疾患に関しては、まず、動物モデルを用いた研究段階を経て、患者さんを対象にした臨床治験を実施するかどうかが判断されます。この様な状況で、スイス・HD Immune社のStefan Bartl博士らは、HDの原因となるHTTに対するMab(MabC6-17)がHDの治療に有効かどうかを検討するため、HDの臨床試験の前段階としてHDのモデルマウスを用いた動物実験を実施しました。HTTは原因となる核内分子であり、ポリグルタミンが伸長することにより凝集性が増して核内封入体を形成しますが、何割かは、核外へ移行し、さらに、細胞外へ放出されて、隣接する神経細胞に播種することにより神経変性が伝播する機序が想定されています(図1)。MabC6-17による治療に関しては、抗体は細胞内に入りにくいため、細胞外に漏出したHTTが標的になると思われます(図1)。このような考えを基づいて、MabC6-17をHDのモデルマウスに5~8ヶ月腹腔内投与した結果、HTTの蓄積、炎症、運動能力は有意に改善したことから、モデルマウスにおいては、MabC6-17受動免疫による治療が有効である可能性が示されました。これらの結果は、HDの臨床試験を支持するものであり、Neurobiology of Disease誌に掲載されましたので(文献1)、今回はそれを紹介いたします。
文献1.
Reducing huntingtin by immunotherapy delays disease progression in a mouse model of Huntington disease, Stefan Bartl et al., Neurobiol Dis. 2024 Jan:190:106376.
HDの原因となるHTTに対する抗ハンチンチン抗体C6-17による受動免疫がHDの治療に有効かどうかをHDの臨床試験の前段階として、HDのモデルマウスを用いた動物実験により検討することを研究目的とした。
これらの結果は、抗HTTMabを用いた受動免疫によるHDの疾患修飾治療の実現可能性と治療効果に関する概念実証を提供することにより、新しいHD治療戦略として抗体医薬の有効性を示唆するものである。