医学・生命科学全般に関する最新情報


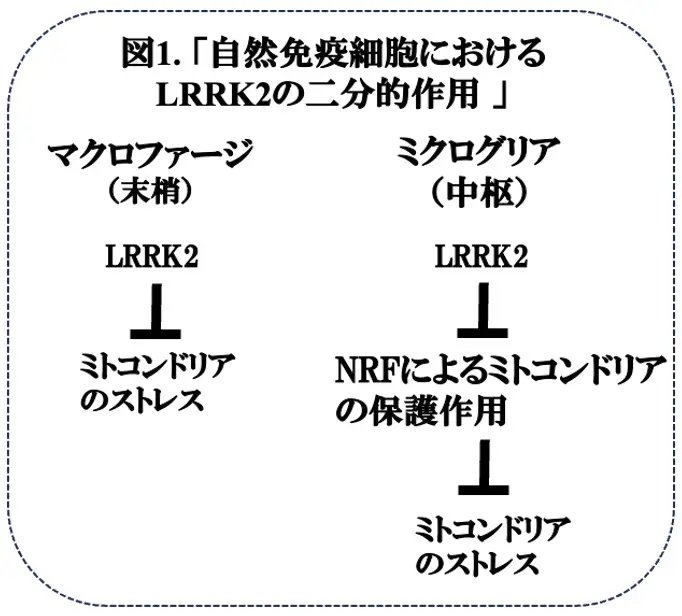
先週お伝えしましたように、LRRK2遺伝子の変異は家族性パーキンソン病(PD)8型(PARK8*3)の原因であり、家族性PDの中でも、特に、孤発性PD患者と臨床症状が類似していることから、LRRK2の生理的・病理的な作用を解明することはPDの病態解明、及び、治療に結びつく可能性があると考えられています。LRRK2は、細胞レベルでは、細胞質に局在し、Ser/Thrプロテインキナーゼなど複数の機能性ドメインから成る巨大なタンパク質(約280 kD)です。LRRK2の主なPD関連遺伝子変異は、酵素活性に関わるドメインにおいて、例えば、G2019SおよびI2020T変異はキナーゼドメインに見いだされていますが、PD発症のメカニズムは不明です。興味深いことに、LRRK2の一塩基多型(SNP)が、ハンセン病*4や炎症性腸疾患であるクローン病*5にリンクすることも報告されており、このことからLRRK2は神経機能のみならず免疫応答においても重要な役割を持つと考えられます。この様な状況で、米国・テキサスA&M医科大学のChi G. Weindel博士らは、以前よりLRRK2KOマウスにおいて、マクロファージのミトコンドリアストレス、炎症が亢進していることを観察していましたが(Wendel C.G. et al, Elife 2020)、今回、脳内マクロファージであるミクログリアにおいては、これらの所見がプロテクトされていました(図1)。そのメカニズムの一つとして、NRFに依存したミトコンドリアの保護作用*6に対するLRRK2の抑制が解除されることが考えられました。これらの結果は、LRRK2の自然免疫細胞に対する作用が末梢と中枢の間で異なることを示唆しており、LRRK2の活性を抑制することがミクログリアのミトコンドリアストレスを抑えることによりPDの治療に結びつくという一つのメカニズムを提供することからも意義深いと思われます。現在レビュー中の論文が bioRxiv. Preprint.に掲載されていますので(文献1)、今回はそれを紹介いたします。
文献1.
LRRK2 kinase activity restricts NRF2-dependent mitochondrial protection in microglia, Chi G. Weindel et al., bioRxiv. Preprint. 2024 July 13
最近、我々は、LRRK2KOマウスにおいて、マクロファージのミトコンドリアストレス、炎症が亢進していることを観察して報告した(Wendel C.G. et al, Elife 2020)。ミクログリアは、脳内マクロファージと言われており、同様な所見が得られるかどうか明らかにすることを本プロジェクトの研究目的とした。
以前のLRRK2KOマウスのマクロファージの解析において、ミトコンドリアの膜ポテンシャルをJC-1やTMREなどの染色液を使った蛍光アッセイにより、インターフェロン誘導遺伝子群の発現(ミトコンドリアによる炎症で上昇する)をRNAシークエンスにより、評価した(Wendel C.G. et al, Elife 2020)。今回は、LRRK2KOマウスより単離した初代培養*7のミクログリアを、ミクログリア細胞株BV-1と共に、同様の方法でミトコンドリアの解析を行った。また、NRFに依存したミトコンドリアの保護作用に注目し、NRF2の発現(mRNA, 蛋白)を調べた。
以上を合わせると、マクロファージなどの自然免疫細胞に対するLRRK2の作用は、末梢と中枢で異なる可能性があり、このことから、LRRK2に関連した疾患の治療に重要かも知れない。