医学・生命科学全般に関する最新情報


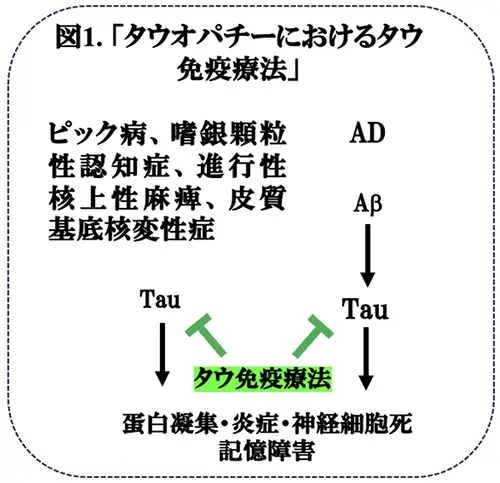
ADで、抗アミロイドベータ(Aβ)モノクローナル抗体(mAb)による免疫療法の第III相臨床試験が成功して以来、他の神経変疾患においても、免疫療法に関する研究が行われています。アミロイドカスケード仮説*4によれば、ADの神経変性過程においてタウはAβの下流に位置すると考えられることや、これまで、ADの重症度とタウが相関することが示されてきたことから、タウの免疫療法には、一定の治療効果が期待できそうです(図1)。また、ADだけでなく、その他のタウオパチーにおいてもタウの免疫療法は治療研究の中心になると思われます(図1)。しかしながら、これまで、タウの免疫療法に関しては、いくつか前臨床実験・臨床試験が行われていますが、いずれも第I〜II相臨床試験の段階で、失敗に終わっていることからも治療戦略の改善が必要と考えられて来ました。この様な状況で、米国・テキサス大学(Medical Branch)のSagar Gaikwad博士らは、以下のような点を改良してタウオパチーモデルマウスを用いてタウ免疫療法の前臨床試験を行いました。まず、タウの凝集体を標的にするモノクロ-ナル抗体を作成しました。これらの抗体は、細胞膜透過性を増すためにミセルに充填され、マウスに経鼻経路で投与されました。2週間後に病理解析したところ、マウス脳におけるタウの蓄積は消失し、認知障害は軽減されることが示されました。これらの結果は、進行期におけるタウオパチー及びその他の神経変疾患の治療開発に意義深いものであり、Science Translational Medicine誌に掲載されましたので(文献 1)、今回はそれを紹介いたします。このようにして、アミロイド抗体治療は、徐々に改善されていくことが期待されます。
文献1.
Nasal tau immunotherapy clears intracellular tau pathology and improves cognitive functions in aged tauopathy mice, Sagar Gaikwad et al., Science Translational Medicine. 3 Jul 2024, Vol 16, Issue 754
タウの凝集がADを含むタウオパチーにおける認知機能低下の原因となるが、これまでのタウの免疫療法による臨床試験は良い結果が得られていない。したがって、動物実験で条件検討し、これを改善するのが本研究の目的である。
これらの研究は、TRIM21を介した細胞内タウ病理のターゲティングとクリアの際の鼻タウ免疫療法が高齢のタオパシーマウスの認知強化に有効性である証拠を提供する。したがって、ADやその他のタオパシーに効果的なタウ免疫療法を設計するのに役立つ可能性がある。