医学・生命科学全般に関する最新情報


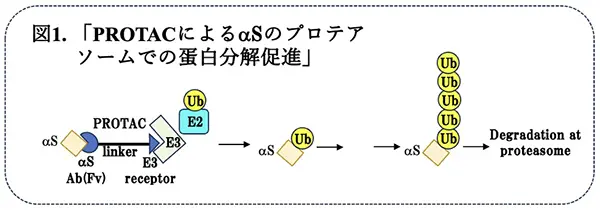
先行するアルツハイマー病(AD)に続いて、パーキンソン病(PD)においても、モノクローナル抗体を用いた受動免疫による臨床治験が行われていますが、現時点で、満足のいく結果は得られていません。(パーキンソン病の治療研究;G2019S LRRK2キナーゼ阻害剤によるミトコンドリアDNA損傷の回復〈2024/9/5掲載〉)。その理由は、必ずしも明らかでありませんが、分泌蛋白であるAβ と異なり、脳内神経細胞の細胞質内蛋白質であるαSに対しては、抗体がアクセスしにくい難点があります。今後、PDを始め多くの神経変性疾患の治療に免疫療法を推進するためには、脳神経細胞内のアミロイド蛋白質を標的にする新しい方法の開発が望まれます。最近、創薬*5の分野で注目されているのが、タンパク質分解標的キメラ(PROTAC)です。PROTACは、標的にするタンパク質に対するリガンドとE3リガーゼから成る化合物で、標的タンパク質とE3リガーゼを接近させてプロテアソームにおける蛋白分解を促進させるというものです(図 1)。米国・グロスマン医科大学のYixiang Jiang博士らは、リガンドに抗α-シヌクレイン抗体(120kD)の可変領域の一部のドメイン(〜15kD)を用いた化合物を開発しました。このような小さな分子量を予測通り、これをPDモデルマウスに投与することにより、細胞内のαSの分解が促進されることが観察されました。現段階では、αSの減少だけでPDの運動症状やその他の非運動症状*6が改善されるかどうかに関しては、今後の研究が必要ですが、PDなどのシヌクレイノパチー、さらに細胞内のアミロイド蛋白質蓄積・凝集を伴う多くの神経変性疾患の新しい治療戦略の可能性として興味深いと思われます。
この結果は、Molecular Neurodegeneration誌(文献1)に掲載されましたので、今回はその論文を紹介いたします。
文献1.
Single-domain antibody-based protein degrader for synucleinopathies, Yixiang Jiang et al., Mol Neurodegener. 2024; 19: 44.
シヌクレイノパチーに対する根本治療薬は無く、最近の免疫療法の臨床治験においても、満足のいく結果が得られていない。本研究においては、αS抗体の可変部単一ドメインとE3ユビキチンリガーゼに対する基質受容体の成分であるセレブロンを介して、αSとE3ユビキチンリガーゼを近接させることにより、αSのプロテアソームにおける蛋白分解を促進させるようデザインした誘導体を開発することを目的とした。
このような化合物の有効性を、シヌクレイノパチーモデルマウス(M83マウス;Giasson BI, et al. Neuron. 2002)や初代培養神経細胞(同マウス由来)において組織学的、及び、分子生物学的に評価した。