医学・生命科学全般に関する最新情報


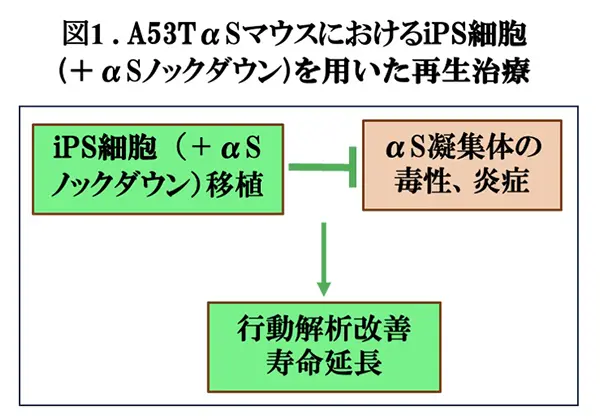
先週お伝えしましたように(iPS細胞を用いたI 型糖尿病の再生医療;第1相臨床治験〈2024/10/24掲載〉の臨床治験が行われており、今後の展開が期待されています。ただ、現時点では、実用化の目処は立っていないことから、いくつか問題を乗り越え徐々に改良して行くのかも知れません。再生医療の対象になるのは多くの場合、老年疾患ですが、最も懸念されるのが、蛋白凝集や炎症の亢進した病的な環境の中で、iPS細胞由来の移植した組織が長期間、生存して機能的に働くことができるのかどうかという疑問です。例えば、PDの場合、胎児中脳の移植が行われてきましたが、患者さんの死後脳の組織学的解析の結果、周囲の変性した神経に由来するαSの凝集体が、移植した神経にもレビー小体を形成することが報告されており、恐らく、周囲の変性した神経からのαSのプリオン様伝幡*4が原因であると思われます。このことは、iPS細胞由来の組織を移植した場合においても、周囲からのαSの凝集による細胞毒性に晒される可能性があることを示唆しており、何らかの対策を講じる必要があります(図1)。最近、台湾台中市・中国医薬大学のChie-Hong Wang博士らは、PDのモデルとしてよく使われるA53TαS発現tgマウスからiPS細胞を調整し、ウイルスベクターを用いたshRNAにより、iPS細胞におけるA53TαSの発現をノックダウンし、A53TαStgマウスに移植した結果、マウスの行動解析の結果が改善し、さらに、寿命が延長することを観察しました(図1)。このことは、iPS細胞を用いたPDの再生治療において、iPS細胞の遺伝子操作が有効であることを示唆しており、重要な知見であると思われます。これらの結果がCell Death Discoveryに掲載されましたので(文献1)、今回はそれを紹介いたします。
文献1.
Neural stem cells derived from α-synuclein-knockdown iPS cells alleviate Parkinson’s disease, Chie-Hong Wang, Cell Death Discovery $volume 10, Article number: 407 (2024)
近年、iPS細胞を用いてPDの再生医療の研究が行われている。iPS細胞を神経幹細胞に分化させて移植することにより、神経細胞の機能を補うことで神経障害の治療に繋がると期待されるからである。しかしながら、神経幹細胞の質やソース、周囲の環境、特にαSの凝集体の毒性に対する適応性など、いくつか課題が残っている。これらの問題が、遺伝的に編集したiPS細胞を用いて解決できるかどうかを検討することが、本論文の研究目的である。
この目的のため、PDのモデルとしてよく使われるA53TαS発現トランスジェニック(tg)マウスのMEFから調整したiPS細胞におけるA53TαSの発現を、レンチウイルスベクターを用いたshRNAによりノックダウンした後(蛋白レベルで約90%減少)、神経幹細胞に分化させた。これを A53TαStgマウス(5ヶ月齢)に移植して(対照群はノックダウンしないiPS細胞を移植)、1週間ごと22週後までその治療効果を種々の行動解析や寿命で評価した。
行動解析の結果、A53TαSの発現をノックダウンしたiPS細胞を移植したマウスは、対照群のマウスに較べて、コオーディネーション能力、バランス能力、自発運動が改善し、寿命が延長していた。
この研究の結果により、iPS細胞を用いたPDの再生治療に遺伝子治療を組み合わせることで革新的な治療に結びつく可能性がある。