医学・生命科学全般に関する最新情報


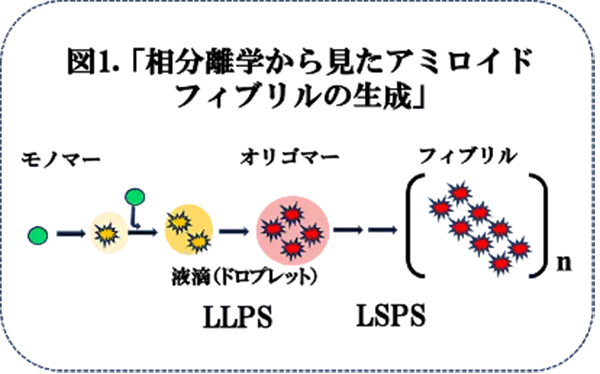
近年、タンパク質やRNAが示すLLPSが種々の生命現象の制御に関与することがわかってきました。これは、濃度の異なる2種類の水溶液が水と油のように分離する現象ですが、細胞内でLLPSにより形成された液滴(ドロプレット)*4(直径約2~5 µmと多彩である)は、膜で覆われていないことから「膜のないオルガネラ」、液滴内には特定の分子が凝縮することから「凝縮体」、とも呼ばれようになりました。特に凝集性が高く、神経変性疾患に関わるようなタンパク質はLLPSを起こしやすく、さらに、LSPSを経て、不可逆的に凝集形成へと移行しうることが示されてきました(図1)。これらの相分離は細胞内環境の変化や遺伝子変異によって促進されます。例えば、PDにおいては、αSのミスフォールディングが、LLPS/ LSPSを経て、アミロイドへと成長するというモデルが提唱されています(Ray S. et al., Nat. Chem. 2020)。これらは、イン・ビトロ(試験管内)の結果に基づいたものであり、生理学的な条件下で証明することが重要です。さらに、これまで、この分野で得られてきた知見は、LLPS/LSPSなどの概念が組み込まれていませんから、再検討する必要があります。このような考えで、中国・華中科技大学(Huazhong University of Science and Technology)のXi Li博士らは、α-/βSの挙動を細胞レベル・固体レベル(線虫)で解析したところ、αSによるLLPS/LSPSの促進効果がβSにより、抑制されることを観察しました。これらの結果は、相分離生物学からの視点からもこれまでの考え方に一致して、α-/βSの相互作用の生理学的重要性を示唆するものでした。したがって、病理学的にも、治療研究に応用出来ることが期待されます。今回は、Nature Communicationsに掲載された論文を紹介いたします(文献1)。
文献1.
β-synuclein regulates the phase transitions and amyloid conversion of α-synuclein, Xi Li, et al, Nature Communications, volume 15, Article number: 8748 (2024)
PDやDLBなどα-シヌクレイのパチーの病理学的特徴は、αSの凝集体の蓄積であるが、最近の報告は、αSが、LLPS/ LSPSを経てアミロイドへと成長するモデルが提唱されている。本プロジェクトの目的は、これが、細胞・個体レベルでどのように制御されているのかをα-/βSの相互作用に焦点を置いて明らかにすることである。
以上の結果を総合すると、相分離生物学の視点から見て、α-/βSの相互作用のバランスが通常の状態とPD/レビー小体型認知症(DLB)の病的状態との間の根底にあり、治療戦略にも重要である可能性が考えられた。