医学・生命科学全般に関する最新情報


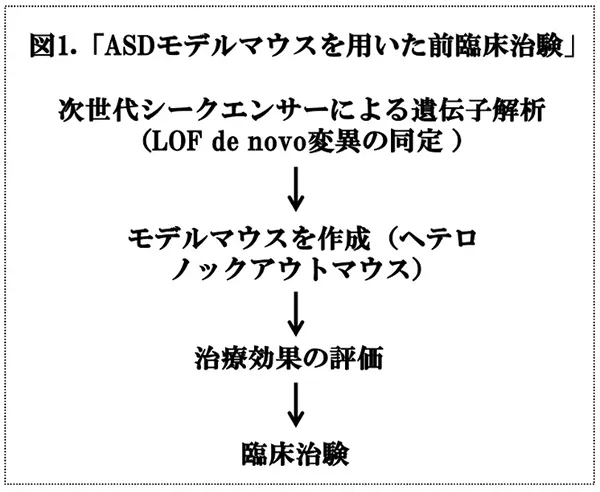
現在、ASDに対する有効な治療法はありません。ASDに対しては、まず、「療育治療」*5による介入を行い、てんかん発作、睡眠障害、不注意、多動性、衝動性、興奮、精神症状や問題行動(暴言・暴力、自傷行為など)が出現した場合には、「薬物治療」を検討します。しかしながら、これらは、対症療法にすぎないので、根本的な治療方法を開発することが重要です。近年、ASDなどの慢性疾患の進行には、de novo変異による遺伝子の機能喪失(LOF)が重要であるという考え方に基づいて、次世代シークエンサーにより網羅的にde novo変異を解析し、変異数の多い遺伝子をノックアウトすることにより、その疾患のモデルマウスを作成するようになりました。このモデルを用いて、病態メカニズムの解明や薬物の効果の評価を行うことが可能になると考えられます(図1)。今回、理化学研究所、順天堂大学、及び、東京大学の共同研究グループは、ASDの原因遺伝子の一つであるKMT2Cのヘテロノックアウトマウスを遺伝子編集(Crisper/Cas9)などの技術を用いて作製し、その変異マウスがASD患者と似た行動変化を示すこと、ASDに関連する遺伝子群の発現変化が脳内で起こっていること、このような行動変化や遺伝子発現変化の一部が薬剤投与によって回復することを報告しました。将来的には診断マーカーや新規治療薬の開発に役立つ可能性が期待されます。これらの結果は、Molecular Psychiatry に掲載されていますので(文献1)、それを紹介いたします。
文献1.
Transcriptomic dysregulation and autistic-like behaviors in Kmt2c haploinsufficient mice rescued by an LSD1 inhibitor, Takumi Nakamura et al., Molecular Psychiatry volume 29, pages 2888–2904 (2024)
最近の研究により、神経系発達障害の病態において染色体と遺伝子発現の制御が重要な役割を持つことが明らかになってきた。人間や齧歯類におけるKMT2C遺伝子の突然変異(H3K4メチルトランスフェラーゼの機能喪失型)のヘテロ接合がASDやKleefstra症候群*6の病因に関連することがわかってきた。しかしながら、KMT2C遺伝子のハプロ不全*7がどのようにして神経系発達障害の表現系の原因になるのか不明であり、これを理解するのが本プロジェクトの目的である。
この目的のため、KMT2C遺伝子のフレームシフト変異をヘテロ接合に持ったCRISPR-Cas9によるゲノム編集マウス(ノックアウトマウス)を疾患モデルとして開発して解析した。
以上、我々の研究は、KMT2C遺伝子のハプロ不全が病因論的にも表面的な妥当性においてもASDのモデルのレパートリーを広げるものである。また、リジン特異的脱メチル化阻害剤の神経発達障害・精神障害に対する治療薬の一般的な有効性を示唆している。