医学・生命科学全般に関する最新情報


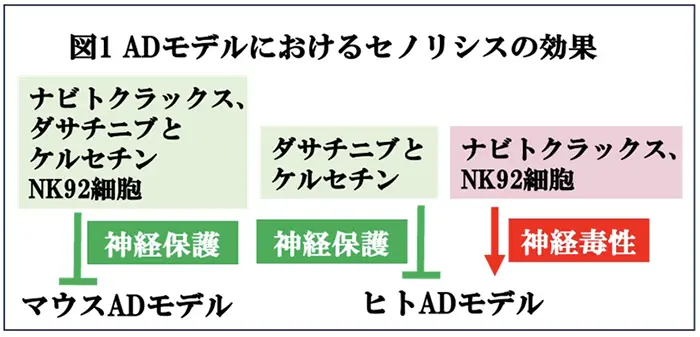
前回、お伝えしました通り、最近では特定の老化細胞がADなどの高齢疾患の病態に重要な役割を担っており、これらの老化細胞が治療の標的になる可能性が注目されています。老化細胞を選択的に除去する手法は、セノリシスと呼ばれており、これまでに数々の老化細胞除去薬が開発されてきました(老化細胞除去による認知・運動機能の改善に関するパイロット研究〈2025/4/10掲載〉)。ADにおいても細胞やマウスのモデルにおいて有望な結果が報告されていることから、AD患者さんの臨床試験への応用が期待されています。しかしながら、注意すべきことは、これまで、抗アミロイドβ (Aβ) モノクローナル抗体を用いたADの免疫療法の開発過程においてマウスモデルで得られた結果をヒト臨床試験において再現するのは難しいという「マウスモデルの結果とヒト臨床試験の結果の乖離現象」が繰り返し、経験されたことです。メカニズムは明らかにされていませんが、当然、セノリシスの治療開発においても同じことが予想されますので、一つの対策として、患者さんの臨床試験へ進む前にヒトモデルを用いた実験系においても有効性を示すことが望ましいと考えられます。このような状況で、米国・カリフォルニア州・Buck老化研究所のChaska C. Walton博士らは、ADの細胞モデルとして、ヒトニューロン、または、アストロサイトのAβ42下での長期培養の系を開発し、このシステムを用いて、以前にADマウスモデルで有効性が示された2つのレジメンi) ナビトクラックス、ダサチニブとケルセチン(DQ) と、ii) 免疫介在性老化細胞アブレーション療法のためのナチュラルキラー細胞株NK92を評価しました。その結果は、ナビトクラックス、および、NK92の介入のリスクを強調し、安全性と臨床伝達性を改善するために前臨床試験においてヒト関連モデルの必要性があることを強調するものでした。今回は、最近のbioRxivに掲載された査読前論文(文献1)を紹介致します。これらの知見が、セノリシスを用いたADの治療開発に役立つことが期待されます。
文献1.
A Human Neuron Alzheimer’s Disease Model Reveals Barriers to Senolytic Translatability, Chaska C. Walton et al. bioRxiv posted February 1, 2025 doi: https://doi.org/10.1101/2025.01.28.635165
ADの免疫療法の開発においてマウスモデルで得られた結果が患者さんの臨床試験において再現出来るとは限らない。最近注目されているセノリシスの場合にも同じことが予想される、一つの可能性は、臨床試験へ進む前にヒトモデルを用いた実験系においてもセノリシスの有効性を示すことである。本プロジェクトは、これを研究目的とする。
その結果、ダサチニブとケルセチン(DQ)は、ヒト由来のニューロン、または、アストロサイト培養システムにおいて細胞保護的に働いたが、ナビトクラックス、および、NK92細胞の共培養は、細胞毒性が認められた