医学・生命科学全般に関する最新情報


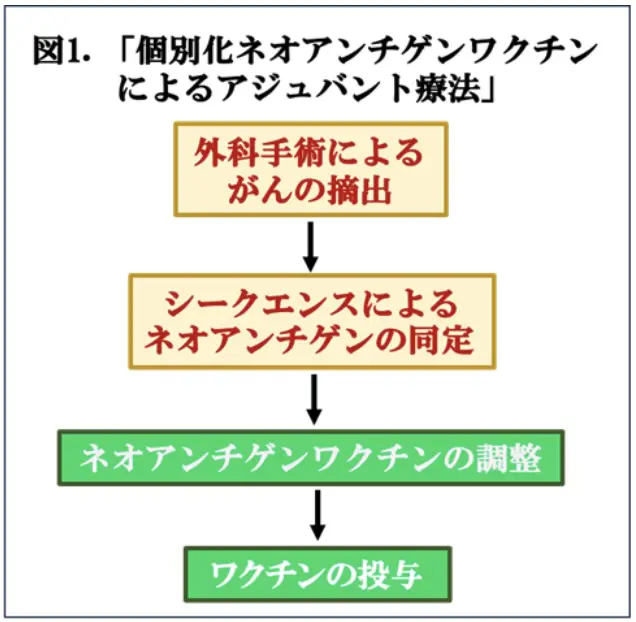
近年,次世代シークエンサーが発達し、ヒトゲノムが解読され,個人のゲノム情報を利用できるようになったため,各々の患者さんよって最適な治療方法を選択するパーソナル医療*2 が可能となって来ました。当然、がんのアジュバント療法においてもパーソナル医療の概念が適用されるようになります。がん免疫療法は、免疫チェックポイント阻害剤*3 の開発により、大きく進歩しましたが、最近、さらに注目されているのが、個別化ネオアンチゲンワクチンです。このワクチンは、患者さんから手術で摘除したがん細胞から、遺伝子変異により生じた新たながん抗原を産生している遺伝子を次世代シークエンサーにより特定します。その情報をもとに患者さん一人一人に対応するネオアンチゲンを含むペプチドよりなるワクチンを作成し、それを投与することでがん細胞を攻撃する免疫反応を引き起こすことが可能になります(図1)。このようにして作成した個別化ネオアンチゲンワクチンに免疫チェックポイント阻害剤を併用すれば、治療効果が増強することも期待されます(図1)。このような状況で、米国・イェール大学医学部のDavid A. Braun博士らは、ステージ3、及び、4の腎細胞がんの手術後のハイリスクの患者さん9例に個別化ネオアンチゲンワクチンをアジュバント療法として投与したところ、術後、40.2ヶ月経過した時点で、どの患者さんも再発はなく、治療による副作用もありませんでした。まだ、第I相臨床試験の段階ですが、これらの結果はインパクトが強いと考えられ、最近のNature誌に掲載されましたので、今回はこの論文(文献1)を紹介いたします。現時点でのがん治療アジュバント療法の主流は、放射線療法や化学療法などですが、副作用のことを考慮しますと、将来的には、個別化ネオアンチゲンワクチンと免疫チェックポイント阻害剤を組み合わせたパーソナル医療が重要になる可能性があります。
文献1.
A neoantigen vaccine generates antitumour immunity in renal cell carcinoma, David A. Braun et al, Nature volume 639, pages 474–482 (2025)
個別化ワクチン投与により、予想されるネオアンチゲンに対して、体内を循環する免疫反応を生み出す事ができるが、そのような反応ががんのドライバー遺伝子変異*4を標的とし、患者さんの腫瘍を認識することにより、臨床的な効果に繋がるかという点に関しては、大部分が不明である。本プロジェクトは、これを腎細胞がんのアジュバント療法において、明確にすることを研究の目的にした。
この目的のため、ステージ3、及び、4の腎細胞がんの摘出手術後の患者さん9例に個別化ネオアンチゲンワクチンをアジュバント療法として投与し、その効果を第I相臨床試験 (識別子 NCT02950766)として解析した。