医学・生命科学全般に関する最新情報


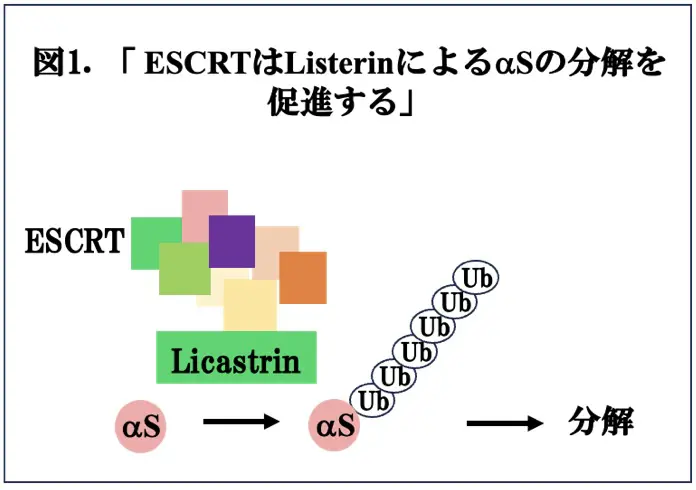
PDの治療研究に関しては、抗αSモノクローナル抗体による免疫療法や抗糖尿病療薬エキセナチド*2の効果が、臨床試験において確認されなかったことから、さらなるメカニズムの解明、及び、それに基づいた新規治療法の開発が必要な状況です。実際、これまでご紹介しておりますように、いくつかのプロジェクトが進行していますが、それ以外にも、押さえておいた方が良いと思われる分子の一つに、ESCRT *3があります。ESCRT(Endosomal Sorting Complexes Required for Transport)は、その名の通り、「輸送にとって必要なエンドソーム調整複合体」であり、細胞膜の再構築に関与することが知られています。 興味深いことに、最近の研究は、ESCRTがαSの分解に重要であり、ESCRTの機能不全がαSの凝集、PDなどの神経変性疾患を促進すると考えられていますが、その詳細なメカニズムは明らかでありません。この問題を明らかにするために、中国・山東大学(Shandong University)のFei Qin博士らは、細胞モデルにおいて、E3ユビキチンリガーゼ#1であるリステリンが、αSのポリユビキチン化を促進し、エンドソームに送り込み、その後、分解させること(図1)、これらの現象の局在はESCRT経路に一致し、ESCRTの機能を抑制するとαSの分解が減少して発現量が増加することを示しました。さらにリステリン遺伝子の条件付きノックアウトマウス*4由来の初代培養神経において、αSの神経変性作用は亢進し、逆に、Α53ΤαSトランスジェニックマウスにおける神経変性所見は、リステリンをウイルスベクターで過剰発現させることにより改善することを示し、リステリンの発現を増大させることがPDの治療に結びつく可能性を提唱しました。これらの結果は、Science Advancesに掲載されましたので、今回は、この論文(文献1)を取り上げます。このようにαS病態のメカニズムに基づいた治療法が開発されることが期待されます。
文献1.
Listerin promotes α-synuclein degradation to alleviate Parkinson’s disease through the ESCRT pathway, Fei Qin et al., 2025, SCIENC ADVANCES Vol 11, Issue 7
DOI: 10.1126/sciadv.adp3672
PDは、中脳黒質のドーパミン神経にαSが過剰に蓄積して神経変性を引き起こすが、αSのクリアランスのメカニズムは不明瞭である。したがって、本プロジェクトは、ユビキチン化αSのクリアランスに対するESCRT経路の促進効果を評価する目的で、細胞・マウスモデルを用いた研究を行った。
本研究の結果は、αS分解のメカニズムを明らかにし、E3リガーゼリステリンがPD治療の有望なターゲットになる可能性を示唆している。