医学・生命科学全般に関する最新情報


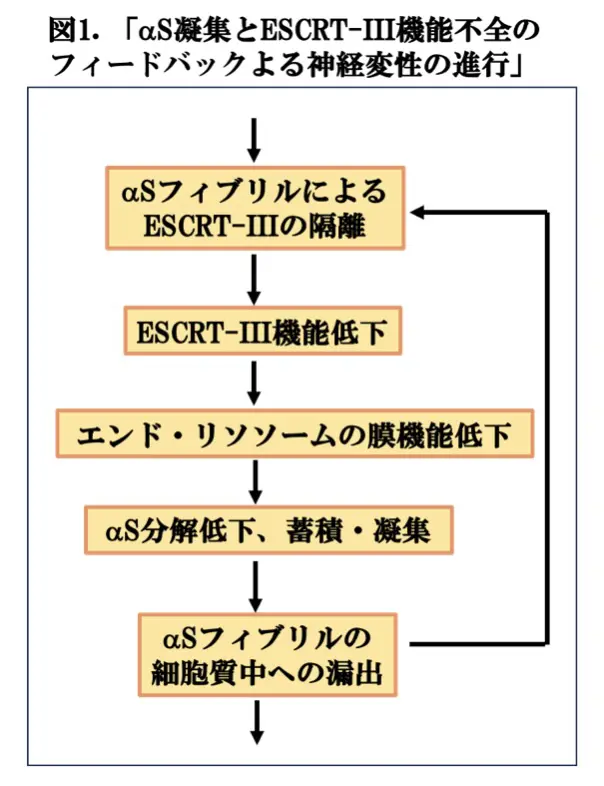
前回、PDなどのシクレイノパチーの病態において、ESCRT*1経路がαSの分解に重要な役割を果たしている事をお伝えいたしました(「リステリンによるESCRT 経路を介したαシヌクレイン分解の促進」〈2025/7/11掲載〉)。他方、αSによるESCRT*1の機能の妨害がPDなどの神経病理に関与しているのではないかという最近の見解によれば、αSの凝集とESCRTの機能不全の相互作用が神経変性病態の進行に重要であると思われます。しかしながら、現時点で、そのメカニズムは明らかでありません。ドイツ・マックスプランク研究所のCole S. Sitron博士らは、細胞モデルとインビトロの再構成の実験を通してこの問題にアプローチし、その結果、細胞内αSフィブリルはESCRTの中でも中心的な役割を果たすESCRT-III系のサブユニットを含む多数の蛋白質を隔離し、それらがプロテアソームで処理(側副分解)され、ESCRT-IIIの量が枯渇して、機能が低下するため、エンドリソソームを通したαSの分解が低下する可能性を示しました(図1)。さらに、ESCRT-IIIによるエンドリソソーム膜修復が抑制されるため、エンドリソソーム膜からαSが漏出することにより、細胞内αSフィブリルの量は増加しました。この様にして、αSの凝集によるESCRTの隔離のフィードバックループが形成され、神経変性を促進すると考えられます(図1)。これらの結果は、査読前論文としてbioRxivに掲載されていますので、今回は、この論文(文献1)を取り上げます。αSだけでなく、その他の細胞質内アミロイド蛋白に関しても同様のメカニズムが成り立つ可能性があり、神経変性疾患に対する一般的な治療法の開発に結びつくことが期待されます。
文献1.
α-Synuclein aggregates inhibit ESCRT-III through sequestration and collateral degradation, Cole S Sitron et al., 2025, bioRxiv Posted January 13, 2025
PDなどのシヌクレイノパチーの病態において、細胞内αS凝集体はエンドリソソーム膜修復のためのESCRT-III系のサブユニットを含む多数の蛋白質を隔離するが、その病理学的意義は明らかとは言えない。これを理解する事を本研究の目的とする。
側副分解とフィードバックによる自己永続化システムの誘発に焦点を当てた治療法が開発されることが期待される。また、αSだけでなく、その他の細胞質内アミロイド蛋白に関しても同様に成り立つ可能性があり、神経変性疾患に対する一般性があるかも知れない。