医学・生命科学全般に関する最新情報


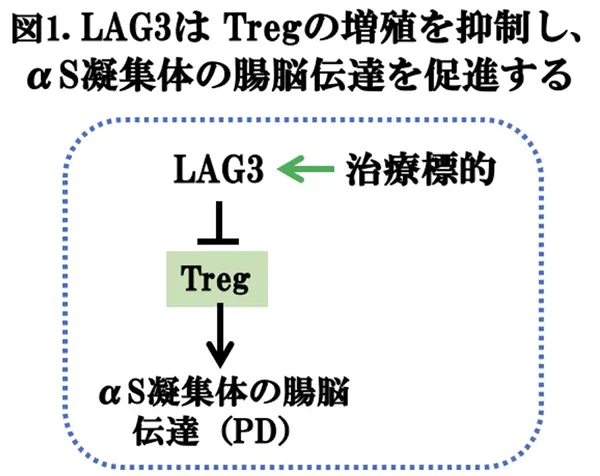
2025年のノーベル生理学・医学賞に制御性T細胞(Treg)の発見が評価され、坂口志文教授(現・大阪大学)らが受賞されました。Tregは、自己に対する免疫応答の抑制を司っているT細胞で、健康人のCD4陽性T細胞のなかの約5%を占めています。Tregの機能異常は、様々な疾患の発症や進行に関係していると考えられます。例えば、Tregが過剰に働くことで、がん細胞に対する免疫反応が抑制され、がんは、免疫細胞からの攻撃を逃れて増殖します。逆に、Tregの抑制機能が低下すると、自己に対する免疫応答の亢進を制御できず、自己免疫疾患を引き起こします。また、慢性炎症を特徴とする生活習慣病や神経変性疾患などの高齢疾患においても、Tregの機能低下が関与することがわかってきました。そのメカニズムの一つとして注目されているのがLAG3です。LAG3はPD-1とCTLA-4に次ぐ第3の免疫チェックポイント分子*4として注目されてきましたが、LAG3は細胞傷害性T細胞や制御性T細胞に発現し、これらT細胞の活性化・増殖を制御する機能を有しています。がんや神経変性疾患では、LAG3の発現量と活性は増大し、T細胞の疲弊が進行する可能性が報告されており、したがって、LAG3は、新たな治療ターゲットとして研究が進んでいます。このような背景で、中国・広州医科大学のWei-Xin Kong博士らは、α-シヌクレイン(αS)腸脳移行モデル*3(PDマウスモデルの一つ)においてLAG-3はTregの増殖抑制を伴ってαSの神経病理を促進することを観察しました(図1)。これは、LAG3がPDの新たな治療ターゲットになる可能性を示唆し非常に興味深いと思われます。結果は、J Neuroinflammationに掲載されましたので、今回は、その論文(文献1)を紹介いたします。
文献1.
LAG3 limits regulatory T cell proliferation in α-synuclein gut-to-brain transmission model, Wei-Xin Kong et al., J Neuroinflammation 2025 Jul 5;22(1):174.
免疫チェックポイント分子の一つであるLAG3は細胞傷害性T細胞やTregに発現し、T細胞の応答・活性化・増殖を制御する機能を有しているが、神経変性疾患では、LAG3の発現量と活性は増大し、T細胞の疲弊が進行する可能性がある。本プロジェクト研究目的は、これをPDの病態モデルにおいて証明し、LAG3を新たな治療ターゲットとして捉えることである。
LAG3ノックアウトマウス(及び、コントロールマウス)を用いて、αS腸脳移行モデルにおいてαSの神経病理所見;チロシンヒドロキシラーゼ、 αS、炎症性サイトカイン、バリア関連タンパク質、CD4陽性T細胞の分化を免疫組織化学、ウェスタンブロット、フローサイトメトリーなどで評価した。
【結論】
我々の結果は、LAG3が本質的にTregの増殖を抑えて、αS凝集体の腸脳伝達を促進する働きがあることを証明するものである。