医学・生命科学全般に関する最新情報


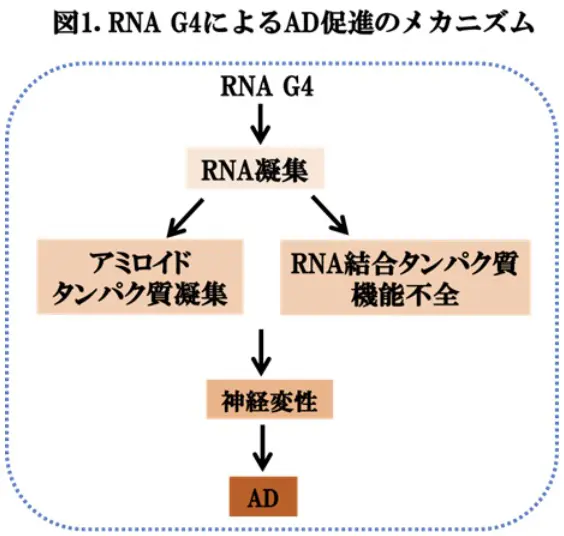
ADやPDなどの神経変性疾患はアミロイド蛋白(アミロイドbやタウ、a-シヌクレインなど)の凝集による神経毒性が病態の中心です。これまで、ADのリスク因子は、主として脳内の蛋白質レベルで研究され、それらの知見に基づいた治療法開発において、一定の成果を上げてきました。一方、AD脳の神経原繊維変化*2などの病理学的プロセスにおいてRNAが重要な役割を果たすと考えられて来ましたが、メカニズムは解明されていませんでした。この問題に関連して、興味深いことに、最近、G4などの核酸構造異常に起因した病態メカニズムの可能性に焦点が当てられるようになりました(図1)。現時点で、メカニズムは十分に明らかになっていませんが、核酸構造異常に起因したRNA転写産物が核内にRNA凝集体を形成し、RNA結合タンパク質がその凝集体に巻き込まれて機能が低下する可能性、また、アミロイド蛋白の凝集を促進することで神経変性を引き起こす可能性などが想定されています(図1)。実際、G4はイン・ビトロで、アミロイド蛋白凝集によるプロトフィブリル形成を促進することが示され、神経変性疾患における蛋白凝集とG4との関連が推定されました。また、RNA G4は、酸化ストレスに応じたストレス顆粒の形成に関与することが示されました。このような状況で、米国・デンバー大学のLena Kallweit博士らは、剖検脳の解析を行った結果、年齢およびADの重症度に応じて、海馬におけるRNA G4の免疫原性が強く増加することを観察しました。この研究成果は、最近のeLife誌に掲載されました(文献1)ので、今回は、この論文を報告いたします。これらの知見からも、神経変性疾患におけるRNA構造のさらなる研究が、今後の診断や治療法の開発において重要であると思われました。
文献1.
Lena Kallweit et al., Chronic RNA G-quadruplex Accumulation in Aging and Alzheimer’s Disease eLife 2025 14:RP105446
世界の人口が高齢化するにつれ、新たなAD患者数は激増しており社会問題になっている。これに対処するためには、加齢とADにおける新たな分子標的を同定し、治療法を開発する必要がある。
本プロジェクトの研究目的は、剖検脳の解析を通して、この問題にアプローチすることである。
この目的のため、加齢とADの進行におけるRNA G4の生成について、剖検脳の海馬におけるRNA G4の発現を検討した。
従来の研究と、RNA G4がストレスに依存すること、およびRNA G4sがタンパク質のオリゴマー形成を促進する際の極めて強い力を示すことを示しており、慢性RNA G4の形成が前駆体の崩壊と関連している神経変性のモデルを提案する。これらの形態学的知見は、神経変性におけるRNA構造のさらなる研究が、今後の治療法や診断において極めて重要な手段であることを示唆している。