医学・生命科学全般に関する最新情報


SARS-CoV-2のゲノムは約30kbの1本鎖RNAから成ります。1本鎖の核酸は、その配列、あるいは環境に依存して、ユニークに折りたたまれ、特徴的な形態をとると予想されます。このような1本鎖核酸では、配列のみでなく、どのような形態をとるかということが、その遺伝情報の機能にも大きな影響を与えることが知られています。遺伝子発現制御に関する長い研究から、RNAのとる構造が、その遺伝子の発現(例えば翻訳過程)のon/offを制御する例は多く知られています。SARS-CoV-2のRNAゲノムも構造を形成し、それらの構造は、RNAを取り巻く環境や、結合するタンパク質などに依存して、ダイナミックに変動する可能性があります。
Groningen大学とTorino大学の研究者は、共存するRNAコンフォメーションを推定する新しいアルゴリズムを創成し、それをSARS-CoV-2 RNAゲノムに応用しました(文献1)。この方法は、DMS-MaPseqという方法によるRNA構造を決定する方法により得られる情報を利用します(文献2)。DMS-MaPseq法は、DMS(硫化ジメチル)が塩基対を形成していないアデニンおよびシトシンを化学修飾すると、そのRNAを鋳型に逆転写酵素で相補鎖DNAを合成した際に修飾部位で変異が導入されることを利用します。この情報により、どのような二次構造が形成されるかを推定することができます。しかし、通常RNAは、複数の構造をとりうるため、異なる構造の情報が含まれるため、正しく予想することが困難な場合があります。今回、DRACO(deconvolution of alternative RNA conformations from mutational profiling experiments)という解析方法を開発し、『どの変異が、ほかの変異と同時に特定の配列領域で起こるのか、あるいは起こらないのか?』を解析することにより、複数のRNA構造を別々に同定できるようになりました。
得られた結果から、SARS-CoV-2RNAゲノムも、複数のconformationをとり、それらはダイナミックに制御されている可能性が示唆されました。DRACO解析により、ゲノム全体の15%くらいに相当する領域で2つの明確なコンフォメーションを取ることが明らかになりました(図)。
そのうちの一つは、読み枠ORF1a-ORF1bの境界部位で、フレームシフト領域と重なっています。この領域はステム=ループ構造を形成し、翻訳の際、一本のRNAから複数のタンパク質の合成を可能にします。もう一つの領域は、翻訳停止コドンおよび、3’末端非翻訳領域に存在し、ここも、2つのコンフォメーションを取ることが明らかになりました。主要なコンフォメーション(63%)は、他のsarbecovirus(サルベコウイルス亜属)に共通に見られる構造です。
これらのRNAの『形』は、ウイルスゲノムの複製や機能発現の上でも重要な役割を果たしている可能性があります。これまで見逃されていた変異の中には、コードしているタンパク質の配列は変化させないが、このようなRNAの形態を変化させてしまうことにより、ウイルスの機能に影響を及ぼしているものもあるので、注意する必要があります。また、これらのRNAの形態を標的とした治療薬の開発も進んでいます。
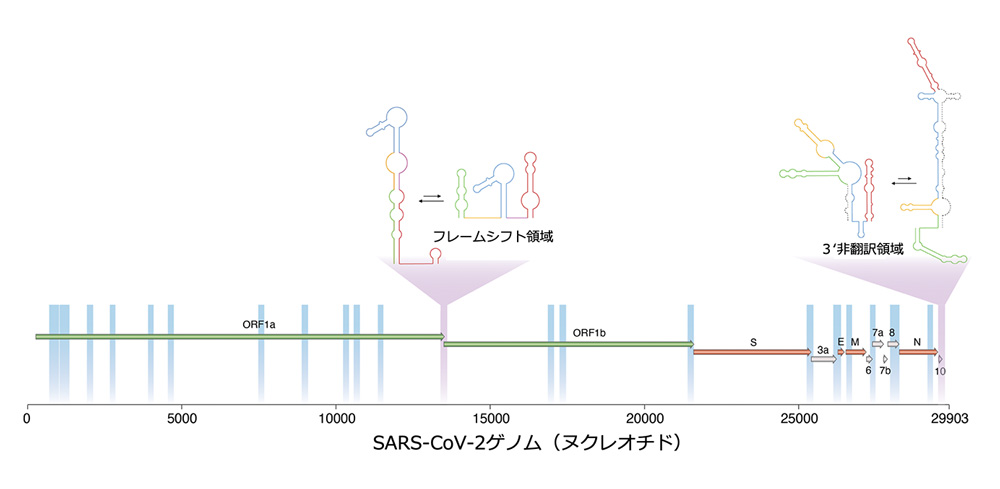
図. SARS-CoV-2ゲノムRNAが形成する高次構造
DRACO法によるSARS-CoV-2のRNAゲノムの解析から、少なくとも2個の領域で、2種類の高次構造を形成していることが明らかとなった。これらの構造は、ウイルスRNAの機能発現や複製に重要な役割をする可能性があり、抗ウイルス薬の標的となる。