医学・生命科学全般に関する最新情報


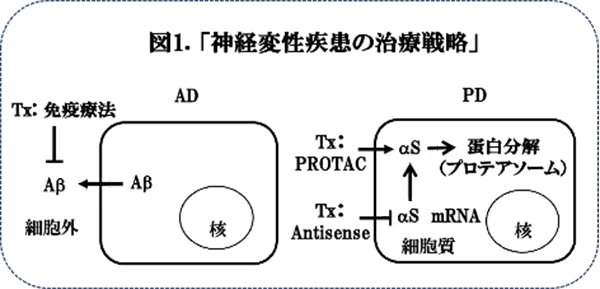
近年、神経変性疾患の治療研究が精力的に行われてきました。アルツハイマー病(AD)に関しては、ご存知の通り、抗Aβモノクロ-ナル抗体;レカネマブやドナネマブ、を用いた受動免疫療法の第3相臨床治験が成功し、FDA*4に承認されました。現時点においては、いくつか問題点がありますが、今後、徐々に改良されて行くのではないかと思われます。しかしながら、ADに比べて、パーキンソン病(PD)やその他の神経変性疾患では、良い結果が得られていません。これは、ADの治療標的であるアミロイドβが細胞外に分泌されるので抗体の標的になりやすいのに対し、PD 治療におけるαSやその他の神経変性疾患の原因となるアミロイド蛋白の多くは細胞質に局在するため、抗体がアクセスしにくいのが原因であると考えられます。そこで、最近では、細胞質のアミロイド蛋白を標的にした新たな治療法の開発が試みられています。これに関連して、αSタンパクのユビキチン化・プロテオソームにおける蛋白分解を亢進させるようなペプチド:PROTAC*5の開発を試みた論文を紹介いたしましたが(E3リガーゼ/抗体可変部キメラを用いたα-シヌクレインの蛋白分解;治療への適用〈2024/9/26掲載〉)(図1)、このように、現在、多くのPDの根本治療法が研究されていますが、やはり、最もオーソドックスなのは核酸療法でしょう。今回は、少し前ですが、東京医科歯科大学の佐野研究員らが共同研究により、野生型マウスにαSの凝集体PEFを投与したPDモデルにおいてαSのASOによる治療効果を証明した結果が、Acta Neuropathologica Communicationsに掲載されていますのでそれを紹介いたします(文献1)。これまで、類似論文がいくつか発表されており(Uehara T et al, Sci Rep 2019, Weber Boutros S et al, J Parkinsons Dis 2021, Cole TA et al, JCI Insight.2021)、核酸療法に対する関心の高さが伺われます。いずれの結果もマウスで得られたものですが、これらの知見が患者さんに応用されてPDの疾患修飾治療として確立されることが期待されます。
文献1.
Effects of local reduction of endogenous α-synuclein using antisense oligonucleotides on the fibril-induced propagation of pathology through the neural network in wild-type mice, Tatsuhiko Sano et al, Acta Neuropathologica Communicationsvolume 12, Article number: 75 (2024)
PDやその他のα-シヌクレインのパチーでは、αSの凝集体が内因性の野生型αSを凝集させることにより神経変性が伝播していく様式が一つのメカニズムとして考えられている。もし、これが正しければ、αSの発現量を低下させれば、αSの凝集による神経変性の伝播を抑制することになり、治療に有効である可能性がある。本プロジェクトの目的は、これを実験的に証明することである。
以上の結果は、神経変性伝播の進展において、神経ネットワークを通して内因性のαSを補充することの重要性を証明するものであり、ASO療法がα-シヌクレイのパチーの治療に有効であることを示唆している。