医学・生命科学全般に関する最新情報


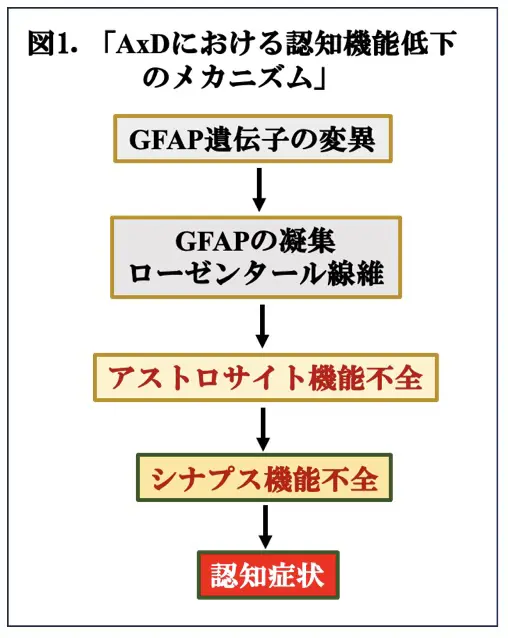
AxDは、GFAP遺伝子のGain of functionによって引き起こされる神経障害であり、変異型GFAPは、野生型に比べて凝集しやすく、グリア細胞質内にローゼンタール線維*4という不溶性の構造物を形成し、アストロサイト機能不全、さらには、白質の脱髄をもたらし、最終的に発達遅延やおよび運動障害、さらには認知障害につながると考えられています(図1)。AxDは非常に希少な疾患であり、これまでに世界で約500人の患者さんが報告されており、本邦の患者数は 270万人に1人と推定されています。それらの多くは致命的であり、現在のところ効果的な治療法はありません。したがって、出来るだけ早く病態のメカニズムの理解に基づいた治療法を確立することが望まれています。最近、米国・カルフォルニア大学デービス校のRobert F Berman博士らは、AxDにおけるアストロサイト機能障害と行動障害との関連をよりよく理解するために、Gfap + / R237Hノックインラットモデルを開発したところ、これらのラットは繁栄の失敗、運動障害、大脳白質欠損など、AxD患者さんの臨床的特徴の多くを反復しました(Berman, Sci Transl Med 2021)。Berman博士らは、引き続き、Gfap +/ R237Hラットが、追加の臨床的に関連する表現型としてシナプス可塑性および認知障害の低減も示し、モデルとしての有用性をさらに実証することを示しました。特に、+/R237H若年成人動物(〜80日齢)における海馬転写分析は、自然免疫応答とシナプスおよび代謝遺伝子発現の喪失を伴う神経変性の特徴を明らかにしました。これらの結果は、アストロサイト機能障害がAxDの学習と記憶障害につながることを示唆しており、AxDラットは、中枢神経系機能に対するアストロサイト病理の影響を調査するための新しいモデルを提供し、AxDおよびアストロサイト病理を有する他の神経変性疾患に対する効果的な治療法のさらなる開発に不可欠なプラットフォームを提供すると思われました。これらの結果は、最近のeNeuro*5に掲載されましたのでその論文(文献1)を紹介致します。
文献1.
GFAP mutation and astrocyte dysfunction lead to a neurodegenerative profile with impaired synaptic plasticity and cognitive deficits in a rat model of Alexander disease, Berman RF et al, eNeuro 2025 Mar 10;12(3):ENEURO.0504-24.2025.
最近、ゲノム編集CRISPR-Cas9法*2により、Gfap + / R237Hノックインラットモデルを開発して解析したところ、これらのラットは、繁栄の失敗、運動障害、大脳白質欠損など、AxD患者さんの臨床的特徴に似た多くの症状を呈した(Berman, Sci Transl Med 2021)。AxDにおける認知症状は主要症状の一つにも関わらず、これまで、言及されていないことから、これを明らかにすることが本研究の目的である。
上記の目的のため、Gfap + / R237Hノックインラットモデルの認知機能の解析を行った。
本研究の結果は、アストロサイト機能障害がAxDの学習と記憶障害につながることを示唆している。したがって、AxDラットは、中枢神経系機能に対するアストロサイト病理の影響を検討するための新しいモデルを提供すると考えられる。