医学・生命科学全般に関する最新情報


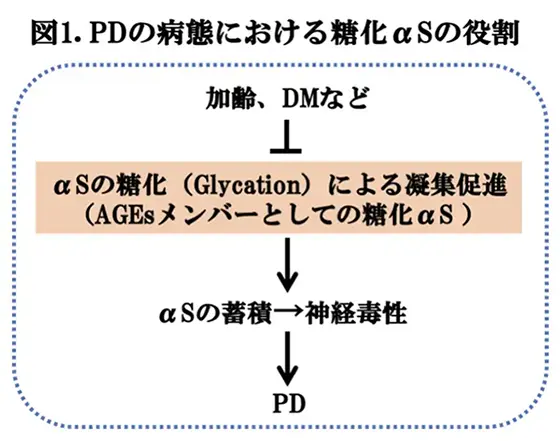
DMは、DM性網膜症、-神経障害、-腎症の、いわゆる、3大合併症をはじめ、多くの疾患と併存することが知られていますが、ADやPDなどの神経変性疾患においても、危険因子として非常に重要です。したがって、DMの治療がADやPDを含む合併症の治療に結びつくことが予想されます。この様な考えに基づいて、II型DMに改善効果を示すグルカゴン様ペプチド-1(GLP-1)受容体作動薬エキセナチドを用いてPDの臨床治験が行われましたが、残念ながら、PDに対する疾患修飾効果を持つことを裏付けるエビデンスは確認されませんでした(エキセナチドのパーキンソン病治療効果は確認されず;第3相臨床試験〈2025/3/4掲載〉)。臨床治験失敗の原因は明らかでありませんが、PDの神経病理の中心は言うまでもなくαSの凝集ですから、DMにおいて、αSの凝集が促進するメカニズム関して、より一層の理解が必要です。また、それらが実際に患者さんの脳で起きているかどうかは、明らかにしなければいけません。この様な状況で、ドイツ・ゲッチンゲン大学メディカルセンターのVasili, E.博士らは、加齢やDMに伴うαSの非酵素的糖化反応の重要性、すなわち、糖化により、凝集性の増加したαSがAGEs*3として蓄積することにより、神経変性病態を引き起こす可能性を考え(図1)、これを培養細胞、モデルマウス、剖検脳の包括的な実験系において証明し、アンチエイジングがこれらの疾患の合併症の治療になるという興味深い仮説を提唱しました。研究結果は、最近、npj Parkinsons Dis.に掲載されましたので(文献1)報告いたします。これらの知見により、PDの新しい治療法の開発に結び着くことが期待されます。
文献1.
Vasili, E., König, A., Al-Azzani, M. et al. Glycation of alpha-synuclein enhances aggregation and neuroinflammatory responses. npj Parkinsons Dis. 11, 307 (2025).
DMは、PDの危険因子として重要であるが、その分子レベルにおけるメカニズムは明らかでない。我々は、加齢やII型DMに伴う非酵素的糖化反応が、蛋白の恒常性を破綻し、神経病理を憎悪する可能性に着目した。
この論文では、MGOやリボースの介在するαSの糖化がαSの凝集、神経炎症、脳のグリオキサラーゼ解毒経路*4機能不全などの神経病理所見の促進に関与する可能性を検討することを研究目的とした。