蛋白質代謝研究室の土屋光研究員、田中啓二理事長、佐伯泰副参事研究員らは、東京大学定量生命科学研究所の深井周也准教授と共同で不要なタンパク質が分解を受ける前に解き解される仕組みについて発表しました。本研究では、ユビキチン選択的シャペロンp97 (Cdc48) (*1)の2つの補因子、Ufd1とNpl4が結合する分子機構を明らかにしました。また、Npl4がLys48でつながったユビキチン鎖(*2)を認識する分子機構を明らかにしました。本成果は、Cdc48–Ufd1–Npl4複合体が形成される分子機構、および標的タンパク質を認識する分子機構を明らかにしたもので、細胞のがん化や神経変性疾患を抑えるための基盤となる知見になると期待されます。
※ 本研究は、文部科学省科および日本学術振興会科研費(新学術領域研究、基盤研究(B)、若手研究)、(公財)武田科学振興財団の研究助成により実施しました。この研究成果は、2019年12月13日に英国科学誌『Nature Communications』にオンライン掲載されました。

ユビキチンは酵母からヒトまで保存された小さなタンパク質で、標的となるタンパク質に目印として付加される事で、標的タンパク質の機能を様々に制御します。このユビキチンは単独でも働きますが、ユビキチンが数珠つなぎになって形成されるユビキチン鎖も重要な情報伝達物質として働きます。ユビキチン鎖はユビキチンのC末端のグリシン残基と、別のユビキチンのN末端アミノ基、もしくはリジン側鎖のアミノ基が共有結合を形成することで合成されますが、結合に使われる残基によってユビキチン鎖は異なる機能を持ちます。細胞内で最も豊富に存在するLys48でつながったユビキチン鎖(Lys48鎖)は、不要なタンパク質や異常タンパク質がプロテアソーム(*3)によって分解・除去される目印として働きます。しかし、プロテアソームはしっかりとした構造のタンパク質を分解するのは苦手なため、多くの場合プロテアソームによる分解の前準備として、Lys48鎖で標識されたタンパク質はCdc48によって解きほぐされる必要があります(図1)。また、ユビキチン鎖の種類は、この解きほぐしの段階で識別されています。Cdc48は2つの補因子、Ufd1とNpl4とともに働きますが、Ufd1はCdc48とNpl4と同時に結合することで複合体の安定化に働き、Npl4がLys48鎖を特異的に認識することでCdc48はLys48鎖で標識されたタンパク質を解きほぐします。Cdc48、Ufd1、Npl4がどのように組み合わさって複合体を形成しているのかという点は、この複合体の形成機構を理解する上で非常に重要ですが、Ufd1とNpl4がどのように結合しているのかは不明でした。また、Npl4がどのようにLys48鎖を認識しているのかということも明らかにされていませんでした。
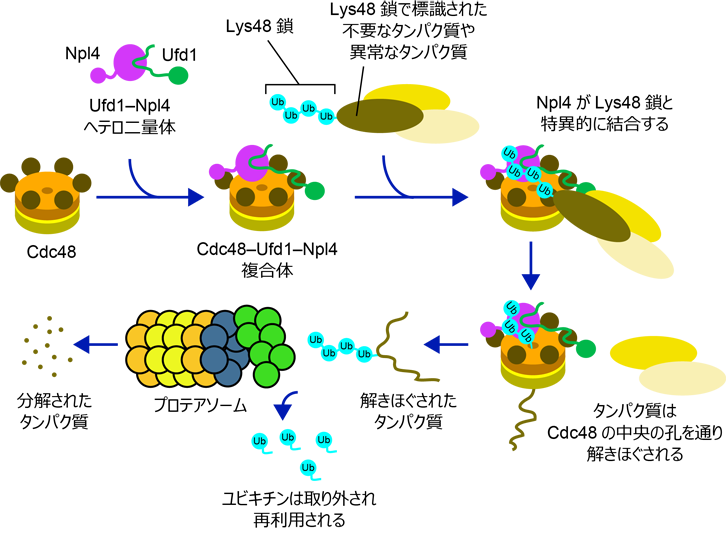
図1. プロテアソームによるタンパク質分解におけるCdc48のはたらき
私たちは、東京大学定量生命科学研究所の深井周也准教授と共同で、Lys48鎖とNpl4とが結合した状態の結晶を作製し、大型放射光施設SPring-8(兵庫県佐用郡)の高輝度X線を利用して立体構造を決定しました(図2、左)。今回作製したLys48鎖はユビキチンを2つつなげたものですが、2つのユビキチンのうち、C末端グリシンを使って別のユビキチンに結合している方を遠位のユビキチン、結合されている方を近位のユビキチンと呼びます。結晶構造中でNpl4は遠位、近位のユビキチンを同時に認識していましたが、変異体解析により遠位のユビキチンが特にユビキチン鎖の結合に重要である事が明らかになりました。一方、近位のユビキチンはNpl4のLys48鎖特異的な認識に影響を及ぼしていることがわかりました。また、Npl4がこれら2つのユビキチンと結合することが、Cdc48–Ufd1–Npl4複合体の活性化に関わることも実験で確認できました。
上記の成果に加えて、Ufd1とNpl4とが結合した状態の結晶についても同様に立体構造を決定しました(図2、右)。今回構造決定に用いたUfd1はアミノ酸20残基に満たない非常に短い領域でしたが、Npl4表面の溝にぴったりとはまり込むように非常に強く結合していました。変異体の結合実験により、構造解析の結果として明らかになった相互作用に関わるアミノ酸の重要性を確認したことに加えて、Ufd1とNpl4の結合が減弱する変異体ではCdc48–Ufd1–Npl4複合体がバラバラに解離してしまい、Cdc48が機能を果たせなくなってしまう事を明らかにしました。
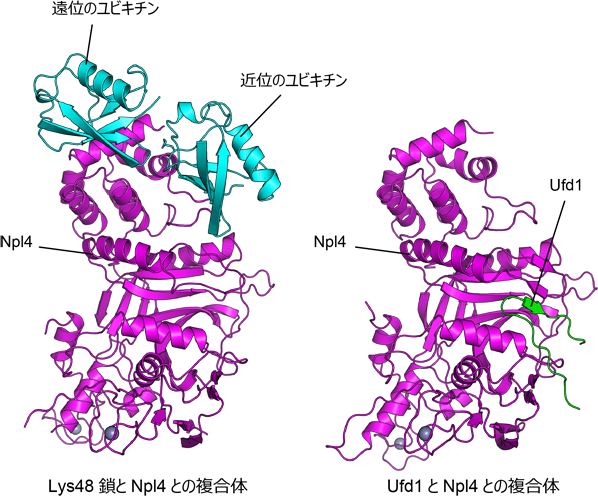
図2. Lys48鎖とNpl4との複合体、およびUfd1とNpl4との複合体の結晶構造
プロテアソームによるタンパク質分解系の破綻はがんや神経変性疾患と密接に関わっており、プロテアソームの阻害剤はすでに抗がん剤として用いられています。さらに、最近ではプロテアソームの前段階で機能するCdc48もまた、有用な抗がん剤の標的となると注目されています。Cdc48の補因子であるUfd1とNpl4との結合を阻害することでCdc48の機能を止めることができるため、本研究で得られたUfd1とNpl4との複合体の立体構造は、将来的に抗がん剤開発の基盤となることが期待されます。