当研究所 蛋白質代謝研究室の安田さや香研究員、土屋光研究員、田中啓二理事長、佐伯泰副参事研究員らは、細胞が環境ストレスに適応するための新しいタンパク質分解の仕組みについて発表しました。本研究は、マックスプランク研究所のRubén Fernández-BusnadiegoグループリーダーおよびWolfgang Baumeister教授、東北大学の稲田利文教授、東京大学の村田茂穂教授らのグループと共同で行い、日本学術振興会科研費(挑戦的研究(萌芽)、基盤研究(A)、若手研究)、文部科学省科研費新学術領域研究「ケモテクノロジーが拓くユビキチンニューフロンティア」(領域代表者:佐伯泰)、日本医療研究開発機構の革新的先端研究開発支援事業(AMED-CREST)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「プロテアソーム機能調節介入による健康寿命の延長」(研究開発代表者:村田茂穂)、(公財)武田科学振興財団、(公財)上原記念生命科学財団の研究助成により実施しました。 この研究成果は、2020年2月5日(水曜日)18時(英国時間)に英国科学誌『Nature』にオンライン掲載されました。

現在、世界の生命科学分野で注目されているキーワードとして「液-液相分離」という現象があります。液-液相分離とは2つの液体が混ざり合わずに互いに排除しあうことで2相に分離する現象のことです。身近な例では、サラダドレッシングが水と油の2相に分かれる状態も液-液相分離で、自然界ではよくみられる現象といえます。最近の研究により、細胞内でも核酸やタンパク質が液-液相分離を起こして周囲とは異なる液相を形成し、水に浮かぶ油滴のように細胞内で液滴を形成することが分かってきました。細胞内には核やミトコンドリアなどの『膜で仕切られたオルガネラ(細胞小器官)』があることはよく知られていますが、タンパク質をはじめとする生体高分子の液滴は『膜のないオルガネラ』として、さまざまな役割を担っていることが明らかになりつつあります。
他方、生物の重要な構成成分の一つであるタンパク質は、生体内のシステムによりその品質を厳密に管理されており、正常な合成と分解のサイクルによって、恒常性が維持されています。細胞内タンパク質代謝における主要な担い手であるユビキチン・プロテアソーム系*1)は、異常タンパク質や役目を終えた機能性のタンパク質を選択的に分解除去することで、タンパク質の恒常性の維持のみならず遺伝子発現、ストレス応答、シグナル伝達など、さまざまな細胞機能の制御に必須の役割を果たしています。近年、細胞質に存在するタンパク質やオルガネラの分解経路が次々と明らかになってきている一方、核内におけるタンパク質の分解機構は未だ解明されていない部分が多く残されています。
本研究グループは、プロテアソーム*2)の細胞内での振る舞いを調べるため、プロテアソームサブユニットに蛍光タンパク質を融合しノックインしたヒト培養細胞株を作製し、蛍光顕微鏡で観察したところ、プロテアソームが高浸透圧のストレスに応答して核内で粒状の構造体をつくることを見出しました。更にこの構造体を蛍光顕微鏡で詳細に調べたところ、細胞内で活発に動き回っていること、互いに融合し1つになること、ほぼ球状であることから、液-液相分離で形成された液滴であることが分かりました (図1) 。一方、プロテアソーム液滴の構成分子を解析したところ、ユビキチン化されたタンパク質をプロテアソームに運ぶタンパク質RAD23B*3)が集積していることが分かりました。続いて、プロテアソームが液滴を形成する分子機構を明らかにするため、精製したユビキチン鎖*4)とRAD23Bの挙動を試験管内で観察したところ、それぞれ単独では液滴が形成されなかったことから、液-液相分離にはユビキチン鎖とRAD23Bの結合が必要であることが分かりました。更にプロテアソームと結合できないRAD23B変異体では、液滴は形成するがプロテアソームは集積しなかったことから、ユビキチン鎖とRAD23Bの相互作用によって液-液相分離が起こり、そこへプロテアソームが動員されることでプロテアソーム液滴が生じることが明らかになりました (図2) 。加えて、核内のプロテアソーム液滴においては、プロテアソームがユビキチンに選択的なシャペロンであるp97*5)と協調して、ユビキチン化タンパク質の分解を誘導することがわかりました。つまり、プロテアソーム液滴は、細胞内の局所的なタンパク質分解を促進させるために形成すること、細胞が環境ストレスに適応するための、新たなタンパク質分解の仕組みの一つであることが明らかになりました。
液-液相分離は新たな細胞内現象として近年高い注目を集めていますが、本研究により、これまで未解明であった核内タンパク質の品質管理機構とも関連していることが明らかになりました。これは、液-液相分離が細胞内における現象に広く関与していることを改めて示すものであり、液-液相分離の視点から細胞内のさまざまな現象の見直しが進むことが予想されます。また、凝集性のタンパク質の集積は、神経変性疾患の発症や進行に関係していると考えられています。従って、タンパク質の分解という品質管理の分子機構の一端を明らかにした本成果は、細胞のがん化や神経変性疾患を抑えるための知見の基盤になると期待されます。
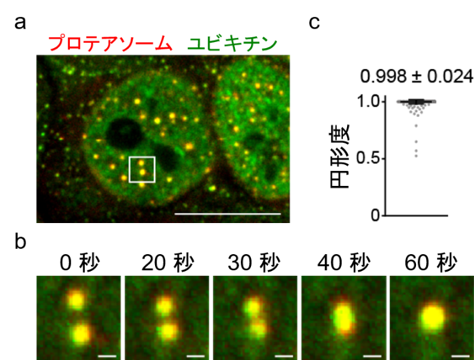
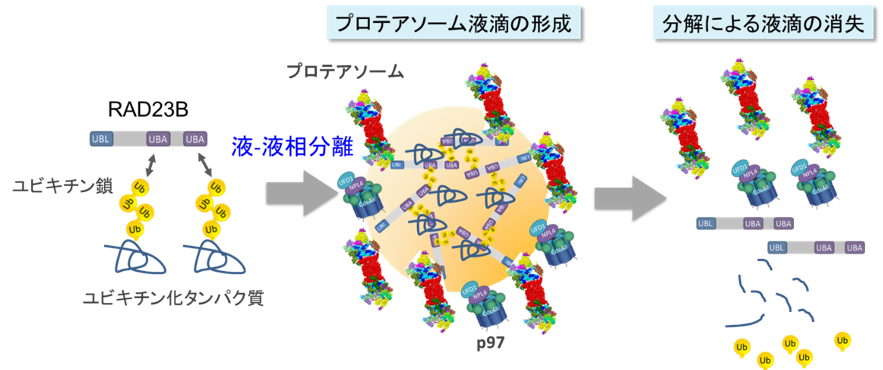
高浸透圧のストレスにより生じたユビキチン化基質(タンパク質)がRAD23Bと液-液相分離し、更にプロテアソームを呼び込むことでプロテアソーム液滴が形成される。プロテアソームによるユビキチン化タンパク質の分解により液滴は消失する。